
Kanser kök hücrelerinin (CSC’ler) keşfi, CSC’lerin kanserlerin başlaması, ilerlemesi ve nüksetmesindeki içsel rolü nedeniyle kanser biyolojisi alanında devrim yaratmıştır. Farklı CSC türlerinin tanımlanması, araştırmacılara ve klinisyenlere çeşitli CSC veya kanser türlerinin temel biyolojisini anlamaları için büyük bir fırsat vermiştir, ve farklı CSC türlerinin tanımlanması, özellikle CSC’leri hedeflemek için yenilikçi yaklaşımların veya terapötiklerin geliştirilmesinde ekstra bir boyut ekledi.
Çeşitli kanserlerin neden olduğu morbidite ve mortalite, son birkaç on yılda hızla azalmaya başlamıştır. Ayrıca kanser hastalarının yaşam beklentisi
CSC’leri hedef alan yeni ilaçların geliştirilmesi ve klinik öncesi test edilmesindeki hızlı ilerlemelerin yanı sıra, modern en son teknolojilerin icadı ile artmıştır. Ek olarak, belirli bir tümör tipine özgü benzersiz hücre belirteçleri deşifre edildiğinde, CSC’lerin moleküler biyolojisi hakkında daha fazla bilgi mümkün oldu. Daha da önemlisi, anahtarın karakterizasyonu ve değerlendirilmesi CSC’lerdeki sinyal yolları kritiktir, çünkü ortaya çıkan kanıtlar CSC’lerinkanser metastazı veya nüksetme sırasında yayılmada önemli bir rol oynar. Bu bölümde yumurtalık, tiroid, melanom ve pankreas kanserlerine özgü CSC’leri tartışıyoruz. Ayrıca temel CSC sinyal yolları hakkında da tartışıyoruz,çünkü onları anlamak, kanser hastalarının tedavisinde kullanılabilecek yeni CSC hedefli ilaçların terapötik stratejilerini veya etkinliğinin değerlendirilmesini geliştirecektir.
2.1 Giriş
Kanser kök hücreleri (CSC’ler) veya tümör başlatan hücreler (TIC’ler), bir hücre alt popülasyonunun tanımlanması ve karakterizasyonunun ardından gün ışığına çıkarıldı,çeşitli malign tümör türlerinde kök hücre özelliklerine sahip olan. NS CSC’ler üzerine kapsamlı çalışmalar, kanserin gelişiminde ve ilerlemesinde heterojen hücre popülasyonu oluşturabilen kök benzeri hücrelerin keşfinden sonra hız kazanmıştır [1]. Kanser kök benzeri hücreler başlangıçta akut olarak tanımlandı.
Dünya çapında birçok araştırmacının dikkatini çeken miyeloid lösemi (AML) ve daha sonra CSC’lerin/TIC’lerin kendi kendini yenileme kapasiteleri nedeniyle çeşitli kanserlerin nüks ve metastatik potansiyelinden sorumlu olduğu keşfedilmiştir [2].
Mevcut raporlar, CSC’lerin karsinomların başlamasında ve ilerlemesinde rol oynadığını göstermektedir; ancak, CSC’nin kökeni belirsizdir [1]. CSC’ler, metastaz ve nüks gibi daha fazla kanser mortalitesine yol açan en ölümcül olaylardan sorumlu olduklarından, CSC’lerin kökenini bulmak zorunludur [3]. CSC’lerin kökenine ilişkin farklı zaman noktalarında bilim adamları tarafından öne sürülen çeşitli teoriler vardır. CSC’lerin kökeni ve biyolojisi, etkili terapötikler geliştirmek için daha iyi bir anlayış gerektirir ve bu nedenle, 16 G. Chengizkhan ve diğerleri, hücre füzyonu, yatay gen transferleri, genetik kararsızlık ve hücresel mikro-ortamın etkileri dahil olmak üzere çeşitli teoriler varsayılmıştır [4].
CSC’ler üzerine yapılan son çalışmalar, proto-onkogenlerin, apoptotik faktörlerin ve mitoz sırasında DNA onarımında yer alan çeşitli genlerin işlevsizliği ile birlikte kök hücrelerde onkojenik isabet veya mutasyonun CSC’lerin/TIC’lerin oluşumuyla sonuçlanabileceğini düşündürmektedir (5). Sigara, alkol ve madde kötüye kullanımı, sağlıksız yaşam tarzı ve onkogenlerdeki ve/veya tümör baskılayıcılardaki epigenetik değişiklikler nedeniyle işlevsiz DNA onarım makineleri gibi hem dışsal hem de içsel faktörler Moleküler biyolojideki güncel gelişmeler, benzersiz hücre yüzeyi belirteçlerinin keşfedilmesine yol açmıştır. Farklı tümör tiplerinin tanımlanması ve karakterizasyonunda kullanılabilir [6] CSC’ler, sürekli kendini yenileme özelliklerine ve karsinomların başlamasını, ilerlemesini ve yayılmasını destekleyen heterojen hücre popülasyonuna farklılaşma yeteneğine sahiptir. Hücre yüzeyi belirteçlerini kullanan CSC’ler,Farklı tümörlerin alt türlerini kategorize etme fırsatını açmıştır. [7]. Bu bölümde, yumurtalık, tiroid, melanom ve pankreas kanserlerinde CSC’leri, hücre yüzeyi belirteçlerini ve anahtar CSC sinyal yollarını tanımlama ve izole etme stratejisini tartışıyoruz.
Çeşitli kanserler arasında, over kanseri kadınlarda kanser ölümlerinin çoğuna katkıda bulunur ve lokal olarak ilerlemiş ve metastatik evreli hastaların 5 yıllık sağkalım oranı %26’dır [8]. Her ne kadar yumurtalık karsinogenezinin başlamasında, meme kanseri tip 1 veya 2 (BRCA1 veya BRCA2) genindeki heterozigotluk (LOH) kaybında ve farklı içsel sinyal mekanizmalarının, yani Kanatsız tip (Wnt) düzensizliğinde hem dışsal hem de içsel faktörler rol oynar. )/β-katenin, Hedgehog, Notch ve transforming büyüme faktörü-β (TGF-β) yolakları, yumurtalık kanserlerinin ilerlemesinden çoğunlukla sorumludur [9]. Ovaryan CSC’lerin (OCSC’ler), farklılaşma 133 (CD133), CD117, CD44, CD24 ve aldehit dehidrojenaz1 (ALDH1) veya ALDH1 ailesi üyesi A1 (ALDH1A1) gibi çeşitli kök hücre belirteçlerinin bir kombinasyonu kullanılarak erken tanımlanması tanıda yardımcı olabilir veya kanserin prognozu, metastatik yumurtalık kanserli hastalar için daha iyi tedavi sonuçları olabilir. [10, 11].
Tiroid kanseri, diğer endokrin ilişkili kanser vakaları arasında yüksek morbidite ve mortaliteden sorumlu olan en yaygın endokrin kanseridir. Çeşitli nedensel faktörlerin ortasında, tiroid CSC’lerinin bir alt popülasyonu, sınırsız replikasyon potansiyeli nedeniyle bu CSC’lerin tiroid malignitesinin başlamasında ve ilerlemesinde çok önemli bir rol oynar. [12]. Tiroid CSC’leri (TCSC’ler), hayatta kalmaları ve gelişmeleri için çok sayıda ayırt edici sinyalleme kaskadının kontrolünü ele geçirir. Tiroid karsinomunda, tiroid CSC’leri, foliküler ve papiller kanserler gibi hem iyi diferansiye tiroid tümörlerinin hem de anaplastik tiroid tümörleri dahil daha agresif farklılaşmamış tümörlerin doku özelliklerini tanımlamak için morfolojik belirteçler olarak kullanılır. CD13, CD133, epitel hücre yapışma molekülü (EpCAM), ALDH ve evreye özgü embriyonik antijen 1 (SSEA-1) gibi çeşitli biyobelirteçler, metastatik ve kemoreztant tiroid tümörlerinde kötü prognozu açıkladıkları için teşhis belirteçleri olarak tanımlanır ve kullanılır. İnsülin benzeri büyüme faktörü 1 (IGF1),Hedgehog, Notch, sinyal dönüştürücü ve transkripsiyon aktivatörü 3 (STAT3) ve 2 Tip Kanser Kök Hücresi 17Wnt/β-katenin yolakları gibi Tiroid kanserlerinin farklı alt tiplerinin başlamasını ve ilerlemesini destekleyen CSC’ler. anahtar sinyallemenin anormal aktivasyonu, tiroidin korunmasında kritik rol oynar.
Melanom için 5 yıllık sağkalım oranı, lokalize evrelerinde %98’dir; bununla birlikte, yüzde, bölgesel için %64’e ve uzakmetastatik melanom lezyonları için %23’e önemli ölçüde düşmektedir [13]. Çentik, Hedgehog ve kemik morfogenetik proteinleri (BMP’ler) gibi çeşitli sinyal yollarının düzensizliği karsinojenezde rol oynar. Bu sinyal yolları, CD133 gibi melanom CSC’lerinin (MCSC’ler) ve çoklu ilaç direnci1 (MDR1), ABC alt ailesi G üye 2 (ABCG2) ve ABC alt ailesi gibi ATP bağlayıcı kaset (ABC) taşıyıcı aile üyelerinin tanımlanmasında kullanılan çoklu kök hücre işaretleyicilerini düzenler. B üyesi5 (ABCB5). CD133 belirteci, kanserin metastatik yayılımı sırasında yüksek oranda eksprese edilirken, ABCG2 ve ABCB5, tümör progresyonunun belirteçleri olarak hizmet eder [14].
Pankreas kanseri, tüm karsinomlar arasında dördüncü yaygın ölüm nedenidir. Kanser uzak bölgelere metastaz yapana kadar, doğası gereği çoğunlukla asemptomatik olan agresif bir kanserdir. Pankreas karsinomu için hasta sağkalım oranı %80 kadar düşüktür, çünkü çoğu zaman kanser yalnızca pankreasta çok ileri bir aşamada veya uzak organlarda metastatik evrede teşhis edilir [15]. Farklı karsinomlar üzerine kapsamlı araştırmalar yeni terapötiklere yol açmış olsa da, hasta sağkalımı veya tedavi sonuçlarında bir miktar iyileşme olmasına rağmen, metastatik pankreas kanserli hastaların ortalama hayatta kalma süresi sadece 2-3 aydır. Son zamanlarda, pankreas tümörlerinde CD44, CD24 ve epitelyal spesifik antijen (ESA) gibi CSC belirteçlerinin tanımlanması, pankreas CSC’lerinin (PCSC’ler) tanımlanmasına yol açmıştır ve erken tanı şansını artırmıştır. CD44+, CD24+ ve ESA+ hücreleri, pankreas kanserlerinde çok katlı tümörijenik potansiyele sahiptir, çünkü bunlar CSC’lerin hayatta kalmasını ve tümörlerin ilerlemesini destekler [16]. Pankreas kanserlerinde hiperaktive olan Wnt/β-katenin, HH, Notch ve fosfoinositid 3-kinaz (PI3K)/RAC-alfa serin/treonin-protein kinaz(AKT)/rapamisinin memeli hedefi (mTOR) dahil olmak üzere birden fazla sinyal yolu vardır. Ve CSC’lerin kendini yenilemesini ve farklı tipteki tümör hücrelerine farklılaşmasını sağlar [17]. Sonraki bölümlerde, bu CSC’ler, farklı karsinomlardaki belirteçleri ve tümör ilerlemesini ve metastazı yönlendiren sinyal mekanizmaları hakkında daha fazla tartışacağız.
2.2 Yumurtalık Kanseri Kök Hücreleri (OCSC’ler)
2.2.1 OCSC’lerin Kökenleri ve İşaretleri
Yumurtalık kanseri, jinekolojik maligniteler arasında en ölümcül kanserlerden biridir ve tedavilerden sonra yüksek relaps oranı nedeniyle dünya genelinde kadınlarda kanser ölümlerinin çoğundan sorumludur. Aynı zamanda yaygın olarak araştırılan kanserlerden biridir. Yumurtalık kanseri araştırması, hücre entümörünün küçük bir alt popülasyonu olan CSC’lerin metastaz, ilaç direnci, kanser nüksü ve yüksek ölüm oranlarından sorumlu olduğunun keşfedilmesine yol açmıştır [18]. CSC’ler, birincil yumurtalık tümörlerinin çoğunda ve18 G. Chengizkhan ve ark. yumurtalık kanseri hücre dizilerinde bulunur. Stewart ve ark. [19] yumurtalık kanseri asitlerinden taze izole edilmiş hücrelerin, malign yumurtalık asitlerindeki CSC popülasyonunu temsil eden yüksek CSC belirteçleri ifade ettiğini bildirdiler.
Malign yumurtalık asitlerindeki CSC popülasyonunu temsil eder.
Tümörlerin doğasını ve invazivliğini tahmin etmek için klinik olarak kullanılan yumurtalık kanserlerinden farklı çok sayıda CSC belirteci vardır. CD24, CD44, CD117, CD133 ve ALDH1/ALDH1A1 gibi OCSC belirteçleri, CSC’leri ve tümörü hedeflemek için daha kesin tedavi stratejileri kullanıldığında, prognoza yardımcı olan ve kanser hastalarının klinik sonuçlarını belirleyen tümör alt tiplerinin kimliği ve sınıflandırılması [20] CD44+ ve CD117+ hücreleri, insan yumurtalık adenokarsinomlarından izole edilir. Hücre yüzey belirteçleri CD44 (hyaluronik asit reseptörü) ve kök hücre faktörü reseptörü (SCFR), ayrıca CD117 veya c-KIT olarak da bilinir. Hücrelerin bu alt popülasyonları, yani yumurtalık adenokarsinomlarından izole edilen OCSC’ler, enjeksiyondan sonra, tümör başlatma kapasiteleri nedeniyle tam gelişmiş tümörler oluşturabildiler [21].
Yumurtalık tümörü asitlerinden veya tümörün kendisinden izole edilen CD44+ ve miyeloid farklılaşma birincil yanıt 88 (MYD88)+ hücreleri ve yumurtalık kanseri hücre dizilerinden EpCAM+ ve CD24+ hücreleri, CSC’lerin/TIC’lerin moleküler özelliklerini gösterir. İlginç bir şekilde, malign yumurtalık kanseri hastalarının tümör örneklerinden izole edilen CD24+ hücreleri, CSC’lerin gelişmiş özelliklerini, yani tümörlerin ilerleme hızını iki katına çıkaran kendi kendini yenileme kapasitelerinden dolayı daha yüksek bir metastatik ve kanser nüksetme potansiyeli göstermiştir [22]. Ayrıca, bu kanser hastaları, bu malignitelerde verimsiz ilaç tedavileri ile sonuçlanan geleneksel kemoterapiye karşı artan direnç gösterdi. Önemli olarak, CD133+ ve ALDH1+ hücre alanları, özellikle başlangıç evrelerinde tümör gelişiminde yumurtalık karsinogenezi ile ilişkilidir ve bu belirteçler, hastalardaki kanserlerin kötü prognozu ve bunların genel hastalıksız sağkalım oranları ile ilişkilidir [23].
2.2.2 OCSC’lerin Tanımlanması, İzolasyonu ve Karakterizasyonu
OCSC’ler, farklı gen ekspresyon paternleri ve moleküler fenotipleri nedeniyle doğaları gereği son derece plastiktir. OCSC’ler normal kök hücrelerin özelliklerine sahiptir, ancak yerleşik yolları veya sinyal mekanizmalarını takip etmez[24]. Bu nedenle, CSC’ler karsinojenezi teşvik eden kendi kendini yenileyebilir. Ek olarak, CSC’ler ayrıca tümörde farklı hücre tiplerine yol açmak için farklılaşmaya uğrayabilir, bu da tümör heterojenliği ve tedavilere karşı artan direnç ile sonuçlanır. Ayrıca, OCSC’ler hayatta kalma ve hipoksiye direnme kapasitesine sahiptir ve besin açlığı altında (örneğin, glikoz olmadan) çoğalma kapasitesine sahiptir [ 25]. Araştırmacılar, multiparametrik akış sitometrisi kullanarak yumurtalık tümörleri veya asitlerinden izole edildikten sonra, OCSC’lerin tümörün başlaması ve ilerlemesindeki rolünü daha iyi anlamaya başladılar [26]. Yumurtalık kanserli hastaların asit sıvısı, OCSC’lerin izolasyonu için bir kaynak olarak hizmet etti [27]. Kök hücre ortamındaki OCSC’ler ve primer yumurtalık kanser hücrelerinin karışımı, santrifüjleme yoluyla bir ficoll yoğunluk gradyanı üzerinde ayrıldı [28]. Daha sonra, OCSC fraksiyonu, hücre yüzeyi markörleri CD117, CD133, EpCAM, ROR1,2 Types of Cancer Stem Cells 19ALDH, SOX2, oktamer bağlayıcı transkripsiyon faktörü 4 (Oct4), Nanog, MYC, ABCB1 ve ABCG2 [29–31]. Ek olarak, Lin28 ve Oct4, moleküler hedefler olarak tanımlandı ve daha sonra OCSC’lerin izolasyonu için kullanıldı [32]. OCSC’lerin in vitro karakterizasyonları için boya dışlama deneyleri, hücre yüzeyi antijen tanımlaması, tümör küresi tahlili ve klonojenik tahliller kullanıldı [33].
CSC’lerin yüzey belirteçleri hakkında derinlemesine bilgi ve tümör tiplerine göre benzersiz ifade etme yetenekleri, spesifik tümörleri daha yüksek hassasiyetle hedefleme olanaklarını açmıştır. Dokularda veya organlarda normal kök hücrelerin immüno-fenotiplenmesinden kazanılan uzmanlık, CSC’lerin izolasyonu ve tanımlanmasında optimal protokollerin standardize edilmesine büyük ölçüde yardımcı olmuştur [34]. OCSC’lerin yüksek düzeyde plastik ve çoklu gücü, onlara farklı mono veya kombinasyon terapilerine karşı kemorezistans yeteneği sağlar. OCSC’ler, hücresel apoptoz mekanizmalarından kaçabilir ve yetişkin kök hücre homeostazını sürdürmekten sorumlu yolları aktive ederek aktif proliferasyon fazına girebilir [35].
Hücrelerdeki normal fizyolojik koşullar altında, tümör baskılayıcılara karşı onkogenlerin ekspresyonunda veya pro-apoptotik-anti-apoptotik yolaklar tarafından sinyalleşmede ince bir denge korunur. Ancak, yumurtalık CSC’lerinde/TIC’lerinde, proapoptotik ile anti-apoptotik sinyalleşme arasındaki ince denge değiştirilir, böylece tümör hücrelerinin hayatta kalma süresi uzatılır veya kanserlerin nüksetmesine veya nüksetmesine yol açar. Özellikle, OCSC’lerin uykuya geçme konusunda doğuştan gelen bir yeteneği vardır. Hareketsiz durum, OCSC’nin hayatta kalma şansını artırır ve yumurtalık tümörü büyümesini desteklemek için metastatik nişlerini oluşturan değiştirilmiş genomlarının korunmasına yardımcı olur. Tersine, OCSC’ler, metastatik sekonder tümörlerini veya tümör nükslerini ve yumurtalık kanseri hastalarının artan ölüm oranlarını açıklayan kendi kendine indüklenen sessizliğini veya uyku halini tersine çevirebilir [36]. Ayrıca, OCSC’lerin sınırsız farklılaşma potansiyeli ve agresif istilası, son derece stresli bir uzaylı-metastatik-ortamda tümör büyümesini sürdürür, kendilerini ve ikincil tümörlerini aktif olarak çoğaltarak ve ayrıca kemokinleri ve büyüme faktörlerini serbest bırakarak kendi daha iyi hayatta kalmalarının bir göstergesi olarak kurar [37].
2.2.3 Yumurtalık Kanserinde Sinyal Verme, Kendini Yenileme, Metastaz ve Farklılaşma
Wnt/β-katenin, HH, Notch ve TGF-β gibi çeşitli sinyal yolları, CSC’lerin/TIC’lerin kendi kendini yenileyebilirliğini ve bakımını düzenlemede yer alır. Spesifik moleküller/inhibitörler kullanılarak bu yollarda spesifik hedeflerin inhibisyonunun, tekrarlayan maligniteler için potansiyel terapötik değere sahip olduğu gösterilmiştir. Düzensiz Notch sinyali, yumurtalık kanseri hastalarının kötü prognozu ile yüksek oranda ilişkilidir ve çoğu durumda, Notch sinyal molekülleri OCSC’lerde yüksek oranda eksprese edilir. Kritik Notch sinyal moleküllerinin aşırı ekspresyonu, yolun düzensizliğini başlatabilir ve yumurtalık tümörü oluşumuna yol açabilir. Peroksizomeproliferatör ile aktive edilmiş reseptör gama (PPARG), siklin D1 (CCND1) ve runt20 G gibi çoklu Çentik sinyalleme hedef genleri, yüksek dereceli yumurtalık seröz adenokarsinomlarının çoğunda DNA metilasyonu dahil olmak üzere epigenetik modifikasyonlara maruz kalır. [38]. Diğer organlardan/dokulardan gelen CSC’lerdeki sinyal yollarına ilişkin mevcut bilgilerin aksine, çekirdek OCSC’nin sinyallemesi hala belirsizdir [39]. Bu nedenle, bu bölümde öncelikle yumurtalık kanserindeki sinyal yolaklarını tartıştık.
Hedgedog sinyal yolunun anormal aktivasyonu, farklı derecelerde yumurtalık kanserleri dahil olmak üzere birçok kanserin gelişiminde rol oynar. Hedgedog sinyali, sferoid oluşturan hücrelerin/OCSC’lerin düzenlenmesi ve büyümesinde ve yumurtalık tümörlerinin ilerlemesinde yüksek oranda rol oynar [40]. Özellikle, Hedgehog sinyalinin inhibisyonu, yumurtalık kanseri hücrelerinde sferoid oluşturma kapasitesinin baskılanmasıyla sonuçlandı. İlginç bir şekilde, HH sinyal yolunun moleküllerinin Wnt sinyal yolu ile çapraz konuştuğu ve WNT2B ve WNT5A gibi anahtar WNT moleküllerini yukarı regüle ettiği gösterildi. Lösin açısından zengin tekrar içeren G-protein kenetli reseptör 5 (LGR5), CD44, CD133 ve diğer Wnt genleri gibi Kirpi sinyal yolunun hedef genlerinin, tümör büyümesi ve ilerlemesi sürecini kolaylaştırdığı bildirilmiştir [41].
Nükleer Faktör – κB (NF-κB) sinyalinin aracılık ettiği inflamatuar sitokin yolu, OCSC’lerin hayatta kalması için esastır. Tümör nekroz faktörü-alfa (TNF-a) aracılı blokaj yoluyla NF-κB sinyal yolunun inhibisyonu, CD44+ yumurtalık kanseri hücrelerinin apoptotik ölümüyle sonuçlandı. OCSC’lerde TGF-β sinyalinin aktivasyonunun epitelyalden mezenkimal geçişe (EMT) neden olduğu ve metastazı desteklediği gösterilmiştir [42].
2.2.3.1 Over Kanserinde Wnt/b-Catenin Sinyal Yolu
Wnt/β-katenin sinyali, embriyogenez, hücre proliferasyonu ve erişkin kök hücre homeostazının sürdürülmesi sürecini düzenleyen evrimsel olarak korunan sinyal yollarından biridir [43]. Geniş bir işlev yelpazesine sahiptir ve diğer çeşitli hücre alt kümelerine farklılaşmak için mezenkimal fenotipi korumak zorunda olduğundan, CSC’lerin yenilenebilirliği için de önemlidir [44]. Wnt/β-katenin kanonik yolu, birden fazla anahtar sinyal molekülüne sahiptir ve yol, aşağı akış sinyal mekanizmasının başlatılması için Wnt ligandının reseptörüne bağlanmasıyla aktive edilir. Sitoplazmadaki yıkım kompleksi, β-katenin’i fosforile eden AXIN, adenomatöz polipozis koli(APC) ve glikojen sentaz kinaz-3β (GSK-3β) gibi farklı proteinleri ve ardından ubikuitin aracılı proteozomal yıkımı içerir. Yolun aktivasyonu sırasında, fosforile edilmemiş β-katenin sitoplazmada birikir, daha sonra çekirdeğe girer ve hedef gen ekspresyonunu indüklemek için transkripsiyon faktörlerinin T-hücresine özgü transkripsiyon faktörü/lenfoid güçlendirici bağlama faktörü (TCF/LEF) ailesine bağlanır [45] . Wnt/β-katenin yolu, kanser sapı, istila ve büyümeyi düzenler ve yumurtalık kanseri dahil olmak üzere çeşitli kanserlerde kilit bir rol oynar [46, 47], çünkü OCSC’leri kendi kendini yenileme kapasitelerini ve heterojen tümör hücre tiplerine farklılaşmak için plastisitelerini artırarak düzenlediğinden [48]. Wnt/β-katenin sinyal yolu, temel hücresel olayları düzenleyen birkaç protein içerir ve bu proteinlerin çoğunun ekspresyonu karsinogenez sırasında değişir [49].
Wnt/β-katenin sinyali, WNT ligandı Frizzled reseptöre (FZD) ve düşük yoğunluklu lipoprotein reseptörü ile ilgili protein 5/6(LRP5)/LRP6’ya bağlandığında aktive olur. Malign over kanseri vakalarının çoğunda, FZD, normal overdekinden daha fazla eksprese edilir ve FZD-pozitif tümörlü kanser hastalarının hayatta kalma oranı daha kötüydü [50]. Ayrıca, Wnt/β-katenin yolu, Wnt inhibitör faktör 1 (WIF1), Dickkopf ailesi (DKK) proteinleri ve salgılanmış kıvrılmış ilişkili protein (SFRP) gibi çeşitli antagonistler tarafından inhibe edilebilir. Daha da önemlisi, SFRP5 doğrudan WNT ligandına veya FZD’ye bağlanır reseptörü ve eylemi inhibe eder, ancak SFRP5’in düşük ekspresyonu, Wnt/β-katenin yolunun kronik anormal aktivasyonu ve agresif yumurtalık kanserlerinin ilerlemesi ile ilişkilidir [51].
β-katenin’in sitoplazmik ve nükleer birikimi, Wnt yolu aktivasyonunun ayırt edici özelliği olarak kabul edilir ve daha yüksek seviyelerde β-katenin sıklıkla çoklu kanserlerde gözlenir. Benzer şekilde, β-katenin(CTNNB1) genindeki mutasyonlar, endometrioid yumurtalık kanserlerinde sıklıkla gözlenir ve çekirdekte β-katenin aşırı ekspresyonu, yüksek dereceli seröz yumurtalık kanserleri ile anlamlı pozitif korelasyon gösterdi [52]. APC, AXIN1 ve AXIN2, yıkım kompleksini kapsayan ve fosforilasyon üzerine Wntpathway’i düzenleyen anahtar sitoplazmik proteinlerdir. Önemli olarak, APC, AXIN1 ve AXIN2 genlerindeki mutasyonlar, çoklu yumurtalık endometrioidadenokarsinom vakalarında gözlenir [53].
2.2.3.2 Yumurtalık Kanserinde Çentik Sinyal Yolu
Çentik sinyali ilk olarak Drosophila’da keşfedildi ve daha sonra memeliler de dahil olmak üzere birçok türde embriyogenez ve nöral gelişim sırasında rolleri olduğu tespit edildi [54]. Çentik yolu, memeli hücrelerinde hücresel proliferasyondan apoptoza kadar önemli bir işleve sahiptir. Hücre kaderinin belirlenmesinden ve farklılaşmasından sorumludur ve ayrıca hücre bölünmesini etkilediği gösterilmiştir. Çentik, komşu hücreler üzerindeki Delta benzeri (DLL1, DLL3, DLL4) ve Jagged (JAG1,JAG2) gibi ligandlara bağlanarak aşağı akış sinyalini ileten bir hücre yüzeyi transmembran reseptörüdür. Temelde insanlarda ifade edilen dört tip Çentik reseptörü vardır: NOTCH1, NOTCH2, NOTCH3 ve NOTCH4 [55]. Bir ligandın Çentik reseptörüne bağlanması, reseptörde, TNF-a-dönüştürücü enzim (TACE) ve γsekretaz tarafından reseptörün proteolitik bölünmesini indükleyen, ardından aşağı akış sinyalleşmesine ve gen düzenlemesine yol açan Çentik hücre içi alanının (NICD) salınmasına neden olan bir konformasyonel değişikliğe neden olur. Çentik sinyali, Tüylü/Bölünmüş Artırıcı (HES) ailesinin birkaç genini düzenler ve HES proteini, siklin D1 ve c-MYC gibi temel sarmal-ilmek-sarmal (bHLH) transkripsiyon faktörlerinin YRPW motif-benzeri protein (HEY) ailesi ile ilişkilidir. Hücrelerin farklılaşmasını ve hayatta kalmasını düzenler.
Notch sinyallemesinin düzensizliğine ilişkin son bilgiler, birçok kanserle yüksek oranda ilişkilidir ve Notch yolundaki genomik değişiklikler yaygın olarak yumurtalık karsinomlarında görülür [56]. Küçük moleküller ve y-sekretaz inhibitörleri (GSI’ler) gibi diğer blokerler kullanılarak bu yolun inhibe edilmesine ilişkin hem in vitro hem de in vivo çalışmalar, önemli antitümör etkileri göstermiştir. Çentik yolu, yumurtalık kanseri ilerlemesinde geniş bir 22 G. Chengizkhan ve ark. rolü oynar. Bu yolun düzensizliği, zayıf hasta sağkalımı ile bağlantılıdır ve metastaz ve anjiyogenezi teşvik eder. Çentik yolu etkiler, C-X-C motif kemokin reseptörü 4 (CXCR4) aynı zamanda stromal hücre kaynaklı faktör-1α reseptörü (SDF1α) olarak da adlandırılır ve yumurtalık kanseri hücrelerinin proliferasyonunu ve göçünü arttırmak için sinyaline aracılık eder [57]. NOTCH1 ve HES1 proteinleri, çalışılan yumurtalık tümörlerinin çoğunda aşırı eksprese edilir. JAG2, DLL1, Manik Fringe (MFNG) ve transdusin benzeri split-1 (TSL1)’in aşırı ekspresyonu yumurtalık adenokarsinomlarında sıklıkla gözlenirken, Deltex, Mastermind (MAM) ve Radical Fringe (RFNG) adenomlarda sıklıkla aşırı eksprese edildi [58]. , 59]. γ-Sekretaz inhibitörleri (GSI’ler) Notch sinyal yolunu inhibe etmek için kullanılır ve bu nedenle yumurtalık kanserleri de dahil olmak üzere farklı kanserlerin birçok klinik denemesinde test edilir (Tablo 2.1).
2.2.3.3 Yumurtalık Kanserinde Kirpi Sinyal Yolu
Hedgehog sinyal yolu, Wnt sinyal yolu ile birlikte yumurtalık tümörijenezine katkıda bulunur [60]. Hedgehog sinyalinin anormal aktivasyonu, yumurtalık karsinomlarının çoğunda gözlenir. Seröz yumurtalık tümör örneklerinde, Wnt hedef geni, AXIN2, Hedgehog reseptör yamalı homolog 1/2 (PTCH1/2), Indian Hedgehog (IHH), Sonic (SHH) gibi ligandlar ve çeşitli transkripsiyon faktörlerinin aşırı ekspresyonu ile birlikte önemli ölçüde eksprese edildi. HHpathway’in çeşitli sinyalleme ve hedef bileşenlerinin bu aşırı ifadesi, ayrıca Wnt yolu ile belirgin çapraz konuşmayı artıran Hedgehog sinyallemesinin hiperaktivasyonundan sorumludur [60].
Tablo 2.1 Yumurtalık kanserinin farklı sinyal yolu inhibitörlerini kullanan klinik denemeler

Glioma ile ilişkili onkogen 1 (GLI1), bir transkripsiyon faktörü ve yamalı reseptör (PTCH), bu önemli yolun ana moleküler bileşenleridir. Liao et al. [61] over kanserlerinde GLI1 ve PTCH1/PTCH2 proteinlerinin aşırı ekspresyonunun zayıf hasta sağkalımı ile ilişkili olduğunu bildirdi. Pürüzsüzleştirilmiş (SMO), Hedgehog sinyalini düzenleyen önemli bir reseptördür. Özellikle, yumurtalık kanseri hücrelerinin SMO inhibitörü, siklopamin ile in vitro tedavisi, hücre büyümesinin ve istilasının baskılanmasına neden oldu, ancak hızlandırılmış apoptoza yol açtı. Hedgehog sinyalinin değiştirilmiş düzenlemesi, hızlı istilaya ve metastaza katkıda bulundu. Ayrıca, Notch sinyali ile birlikte hedgehog sinyali, neoanjiyogenez ve epitelden mezenkimal geçişe (EMT) yoluyla tümör büyümesini kolaylaştırdı ve potansiyel tümör nüksetmesini arttırdı. Hedgehog sinyali üzerine yapılan çalışmalar, bu yolun temel anlayışını ve kanser ilerlemesindeki rolünü çözerek, spesifik terapötik hedeflerin tanımlanmasına ve yumurtalık kanseri tedavileri için yolu hedefleyen çeşitli inhibitörlerin geliştirilmesine yol açmıştır [62].
2.2.3.4 Dönüştürücü Büyüme Faktörü (TGF)-b Yumurtalık Kanserinde Sinyal Yolu
TGF-β’nın hipersinyalleşmesi, yumurtalık kanserlerinin yayılmasında önemli bir rol oynar. TGF-β sinyali, immün kaçınma, neoanjiyogenez ve gelişmiş EMT yoluyla tümör ilerlemesini destekler [63]. TGF-β süper ailesinin çeşitli üyeleri vardır ve yumurtalıkların normal fizyolojisinde önemli bir rol oynarlar ve ayrıca folikül gelişimine yardımcı olurlar. Ayrıca oosit, granüloza ve teka hücreleri gibi yumurtalıktaki farklı hücre tipleri arasındaki önemli iletişime aracılık eder[63]. Granüloza hücrelerinde çatal kafalı kutu proteini O1/3 (FOXO1/3) ve fosfataz ve tensin homologunun (PTEN) tükenmesi, aktivin seviyesini artırdı ve bu, Sma- ve MAD (dekapentaplejik annelere karşı) homologunun fosforilasyonunun ve aktivasyonunun artmasına neden oldu 2/ 3 (SMAD2/3), granüloza hücrelerinin aktif proliferasyonu ve yumurtalıkta tümör oluşumu ile sonuçlanır. Ayrıca, koşullu SMAD1 ve SMAD5 çift veya SMAD1, SMAD5 ve SMAD8 üçlü nakavt fareler, yumurtalık kanserlerinin başlaması ve oluşumunda BMP-SMAD1/5/8 sinyalleşmesinin rolünü doğrulayan metastatik granüloza hücreli tümörler geliştirdi [64]. İlginç bir şekilde, TGF-β reseptör tip I ve II (TGFβRI ve TGFβRII) ikili inhibitörleri kullanılarak ligand-reseptör bağlanmasının inhibisyonu, bu yolun önemini vurgulayarak tümörlerin boyutunda azalma ile sonuçlandı. TGFβRII ve SMAD sinyali, NF-κB sinyal yolunun aktivasyonu ve CD44 ve matrixmetalloproteinaz 9 (MMP9) gibi diğer faktörler yoluyla yumurtalık kanseri hücrelerinin istilasını destekleyen kanserle ilişkili fibroblastlar (CAF’ler) tarafından düzenlenir [65].
2.2.3.5 Yumurtalık Kanserinde Nükleer Faktör (NF)-kB Sinyal Yolu
Nükleer faktör (NF)-κB olarak da bilinen aktive B hücrelerinin (NF)-κB nükleer faktör kappa-hafif zincir güçlendiricisi, birçok kanserde proinflamatuar sinyallemeye aracılık ettiği gösterilen bir transkripsiyon faktörüdür [66, 67]. NF-κB sinyallemesindeki anahtar moleküllerin aktivasyonu ve düzensizliği, kemodirenç, bağışıklık kaçırma, yumurtalık kanserlerinde metastaz ve en önemlisi OCSC’lerin korunmasından sorumludur. G. Chengizkhan ve ark.TGF-β’nın hipersinyalleşmesi ve NF-κB sinyalizasyonu ile çapraz konuşmasının yumurtalık kanserlerinin yayılması ve metastazı ile sonuçlandığı bildirilmektedir [68]. Birçok farklı kanserde anti-apoptotik ve pro-anjiyojenik yolakta NF-κB sinyalinin rolü iyi bilinmektedir ve ayrıca yumurtalık kanseri ilerlemesinde çok önemli olduğu gösterilmiştir. Tümör mikroçevresindeki (TME) inflamatuar kemokinler veya sitokinler, V-Rel avian retiküloendotelyozis viral onkogenhomolog A (RELA), aynı zamanda NF-KB 65-kilodalton (kDa) alt birimi (p65) proteini olarak da adlandırılan kanonik NF-κB sinyalini aktive eder[ 69]. Ayrıca, artan p65 fosforilasyonu ve pro-tümör makrofaj tip2 (M2) infiltrasyonu, kanonik NF-κB sinyalinin aktivasyonunu tahrik eder ve böylece fare modelinde gözlemlendiği gibi yumurtalık tümörlerinin ilerlemesini indükler. Önemli olarak, NF-κB sinyalinin inhibisyonu, M2’de bir azalma ve antitümör makrofaj tip1 (M1) infiltrasyonlarında bir artışla birlikte tümörü geriler [70]. Önemli olarak, ksenograft fare modelinde p65 kaybı, sferoid oluşumunu, ALDH ekspresyonunu ve aktivitesini, kemorezistansı ve tümör oluşumunu önemli ölçüde inhibe etti. Bu çalışmalar, kanonik NF-κB sinyalinin OCSC’ler tarafından kendi kendini yenilemeleri için kullanılabileceğini ve bu nedenle ALDH ekspresyonunun inhibisyonunun potansiyel olarak NF-κB yolunu kapatabileceğini düşündürmektedir[71]. Bu nedenle, NF-κB yolunda yer alan moleküller, tedaviye dirençli yumurtalık kanserlerini tedavi etmek veya tedavi etmek için yeni ve güçlü inhibitörler/düzenleyiciler geliştirmek için terapötik hedefler olarak hizmet edebilir.
2.2.4 Yumurtalık Kanseri/OCSC’ye Özgü Terapötikler ve Sonuçlar
Kemoterapi ve radyoterapi gibi mevcut tedavilerin çoğu OCSC’leri hedef almamaktadır; bunun yerine yumurtalık kanseri hücrelerinin heterojen popülasyonu arasındaki farklılaşmış hücreleri hedeflerler. Ek olarak, tümörün cerrahi olarak debulkasyonu ancak düşük dereceli yumurtalık tümörleri ile mümkündür. Metastatik yumurtalık kanseri durumunda, cerrahi hacim giderme bir seçenek değildir. Gelişmiş hassas cerrahi aletler ve debulking prosedürü ile bile, sadece morfolojik gözlemden tüm kanser hücrelerini çıkarmak için net bir yumurtalık kanseri marjı elde etmek mümkün değildir. Konvansiyonel tedaviler sadece farklılaşmış yumurtalık kanseri hücrelerini hedef alacak şekilde tasarlanmıştır, ancak OCSC’ler, tümör nişlerinden dolayı [72]. OCSC’ler sıkıca kapsüllenmiştir ve TME’leri içinde iyi korunurlar, bu da OCSC’leri geleneksel tedavilerle hedeflemeyi ve yumurtalık kanserini tedavi etmek veya tedavi etmek için ortadan kaldırmayı zorlaştırır. Tümör başlangıçta kemo- veya/veya radyoterapi ile tedavi edildikten sonra küçülürken, nişlerinde korunan OCSC’ler, uzun süreli kemo- veya radyoterapiden sonra hareketsiz veya uyku durumundan geri dönebilir, bu da yumurtalık kanserinde kemo-direnç veya radyo-direnç gelişimine yol açar [ 73]. Kanser nüksü, herhangi bir kanser tedavisinde kritik bir konudur, ancak önemi çeşitli faktörlere bağlı olabilir. CSC’ler, yumurtalık kanseri de dahil olmak üzere çoğu kanserde kanserin nüksetmesinden sorumludur. Yumurtalık kanseri için 5 yıllık sağkalım oranı nispeten yüksek olmasına rağmen, metastatik ve nükseden yumurtalık kanserlerinde sağkalım oranı çarpıcı biçimde düşmektedir [74]. Nükseden yumurtalık kanserleri, daha önceki ilaç tedavi rejimleri nedeniyle sıklıkla kemoreztanttır. Bu nedenle, a2 Kanser Kök Hücre Tipleri Yumurtalık CSC’lerinin/TIC’lerinin kapsamlı bir şekilde anlaşılması, yumurtalık kanseri metastazı ve nüksü ile mücadeleye daha fazla ışık tutacaktır. Dolayısıyla, yumurtalık CSC’lerini/TIC’lerini hedeflemek, geleneksel terapilerden daha iyi bir terapötik strateji olacaktır (Şekil 2.1) ve bu nedenle, gelecekte yumurtalık kanseri hastalarının tedavisi için yeni bir terapötik seçenek olarak hizmet edebilir. Bölümde. Bu kitabın 16’sında, “Kanser Kök Hücreleri için Hedefleme Tedavileri” daha ayrıntılı olarak tartışılmaktadır.
2.2.5 Yumurtalık Kanserleri için Klinik Araştırmalar
Şu anda, yumurtalık kanserinin tedavisi için çok sayıda terapötik yaklaşım mevcuttur. Günümüzde yumurtalık kanseri tedavisinde kemoterapi ve radyoterapi gibi geleneksel tedavilerin yanı sıra immünoterapi de kullanılmaktadır. Konvansiyonel tedaviler CSC’leri hedef almaz ve bu nedenle metastaz ve kanser nüksü yumurtalık kanseri tedavisinde hala önemli bir sorundur. Bu nedenle, yumurtalık karsinogenezinde yer alan çeşitli sinyal yollarını hedeflemek için yeni stratejiler tasarlanmaktadır. Sinyalleme yolları, nakavt/knockdown stratejileri, aptamerler veya küçük molekül inhibitörleri kullanılarak inhibe edilir. Yumurtalık kanseri için farklı inhibitörler kullanılarak yürütülen klinik araştırmalar Tablo 2.1’de listelenmiştir.
[75, 76].
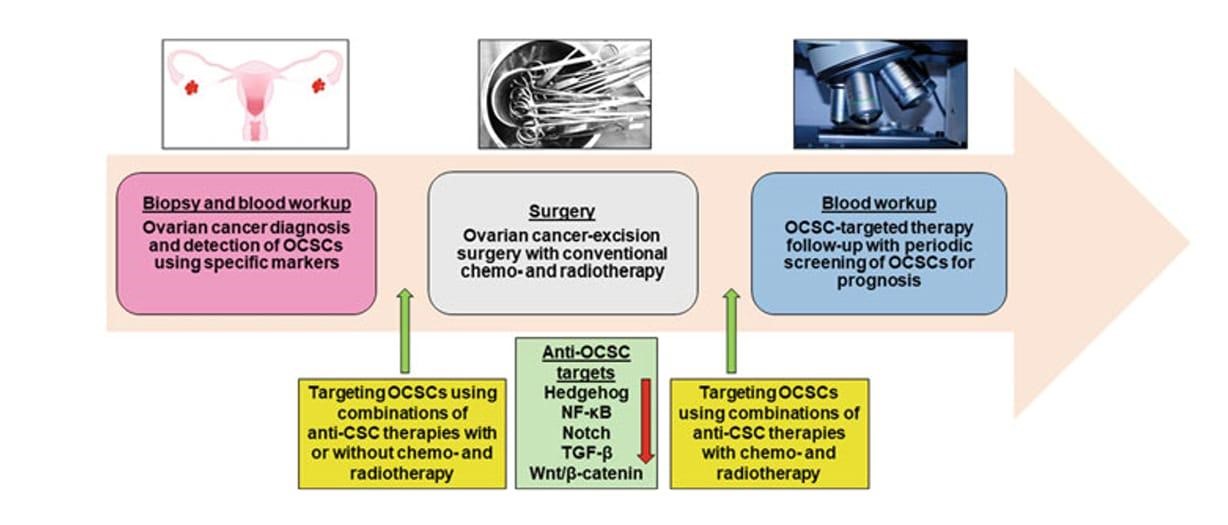
Şekil 2.1 Yumurtalık kanserinin hedefe yönelik tedavisinin teşhisi/prognozu için potansiyel kombine tedaviler için stratejinin şematik gösterimi. Kanser kök hücrelerinin (CSC’ler)/yumurtalık kanseri kök hücrelerinin (OCSC’ler) keşfinden ve bilim adamları tarafından tümör oluşumundaki rollerinin gösterilmesinden bu yana, CSC’ler/OCSC’ler artık klinisyenler tarafından yumurtalık kanseri dahil farklı kanser türlerinin teşhisi/prognozu için izole edilmekte, karakterize edilmekte ve kullanılmaktadır. OCSC’ler tanı/prognozda zaten kullanılıyor olsa da, OCSC’leri over kanseri tedavisi için diğer geleneksel tedavilerle kombinasyon halinde hedeflemek bazı avantajlar sağlayabilir. Yumurtalık kanseri nüksü ve/veya direnci açısından değerlendirici şansını azaltabilir ve böylece hastaların hayatta kalma oranını artırabilir.
2.3 Tiroid Kanseri Kök Hücreleri (TCSC’ler)
2.3.1 TCSC’lerin Kökenleri ve İşaretleri
Tiroid kanseri dünya çapında en yaygın endokrin kanserdir ve histopatolojik özelliklere göre sınıflandırılır [77]. Dünya Sağlık Örgütü (WHO) sınıflamasına göre tiroid kanseri, foliküler tiroid karsinomu (FTC), papiller tiroid karsinomu (PTC), medüller tiroid karsinomu (MTC) ve anaplastik tiroid karsinomu (ATC) olmak üzere dört alt tipe ayrılır. ve FTC diferansiye tiroid kanserleridir (DTC) ve diğer alt tipler arasında vakaların neredeyse %90-95’inden sorumludur [78]. MTC, tiroid bezinin parafoliküler hücrelerinden veya C hücrelerinden kaynaklanır. MTC’nin prognozu, DTC’den (PTC ve FTC) nispeten daha kötüdür. Ayrıca, uzak metastazlı MTC hastalarının sağkalımları zayıftır. Çeşitli çevresel kanserojen faktörlerin ve genetiğin katkılarının yanı sıra, TCSC’ler, mezenkimal özellikleri nedeniyle heterojen hücre popülasyonunun aktif farklılaşmasında rol oynar ve hızlı tümör büyümesini ve sıkıntısını kolaylaştırır. TCSC’lerin tiroid kanserinin ilerlemesindeki rolü iyi belgelenmiştir ve malignite, çeşitli tedavilere direnç ve kanser nüksetmesinden sorumlu olduğu gösterilmiştir[79]. Tiroid CSC’lerinin kökeni hakkında önerilen iki farklı modeli açıklamak için farklı teoriler varsayılmıştır: çok aşamalı karsinogenez modeli ve fetal hücreli karsinogenez modeli. Çok aşamalı karsinogenez modeli teorisi, tiroid kanseri hücrelerinin, çoklu karsinojenik faktörlere veya ksenobiyotiklere maruz kalma nedeniyle epigenetik mutasyona uğrayan tirositlerden kaynaklandığını varsaymaktadır (Şekil 2.2a). Bununla birlikte, fetal hücre karsinogenez modeli teorisi, tiroid kök hücreleri, tiroblastlar ve protirositler gibi fetal tiroid hücrelerinin, onkojenik mutasyonlar nedeniyle CSC’lerin plastisitesini ve özelliklerini kazandığını belirtir (Şekil 2.2b) [80].
Tiroid CSC’leri, anin vitro çalışmada tirosfer oluşturma yetenekleri ve in vivo çalışmada tümörler ile tanımlanabilir. Farklı tümör tiplerini tanımlamak için çeşitli biyobelirteçler kullanılır ve bunlar daha iyi terapötik tedaviye yardımcı olur [12]. Tiroid CSC’ler, CD133 (prominin-1), Oct-4, Sox2, Nanog ve ALDH gibi farklı biyolojik belirteçlere dayalı olarak kanserli olmayan hücrelerden ayırt edilir. Ayrıca, Notch (HES1, JAG1) ve Wnt(MYC, JUN ve FZD5) sinyal yollarını içeren bu tiroid CSC’lerinin bakımında içsel sinyal yollarını yönlendiren farklı kök genleri vardır [81]. Bu belirteçlerin tanımlanması tiroid tümörlerinin saptanmasında net bir anahat göstermiş olsa da, bu tiroid CSC’leri invaziv fenotiplerini EMT sırasında kazanır. Tiroid CSC’leri hücresel yapışma ve polarite özelliklerini kaybeder ve onlara plastisite veren mezenkimal özelliklerini kazanır. E-kadherin ifadesindeki azalma ve N-kadherin ve Salyangoz, Slug ve çinko parmak E-kutu bağlayıcı homeobox 1 ve 2 (ZEB1, ZEB2) gibi diğer belirteçlerin artan ifadesi, EMT süreci ile yüksek oranda ilişkilidir [82].
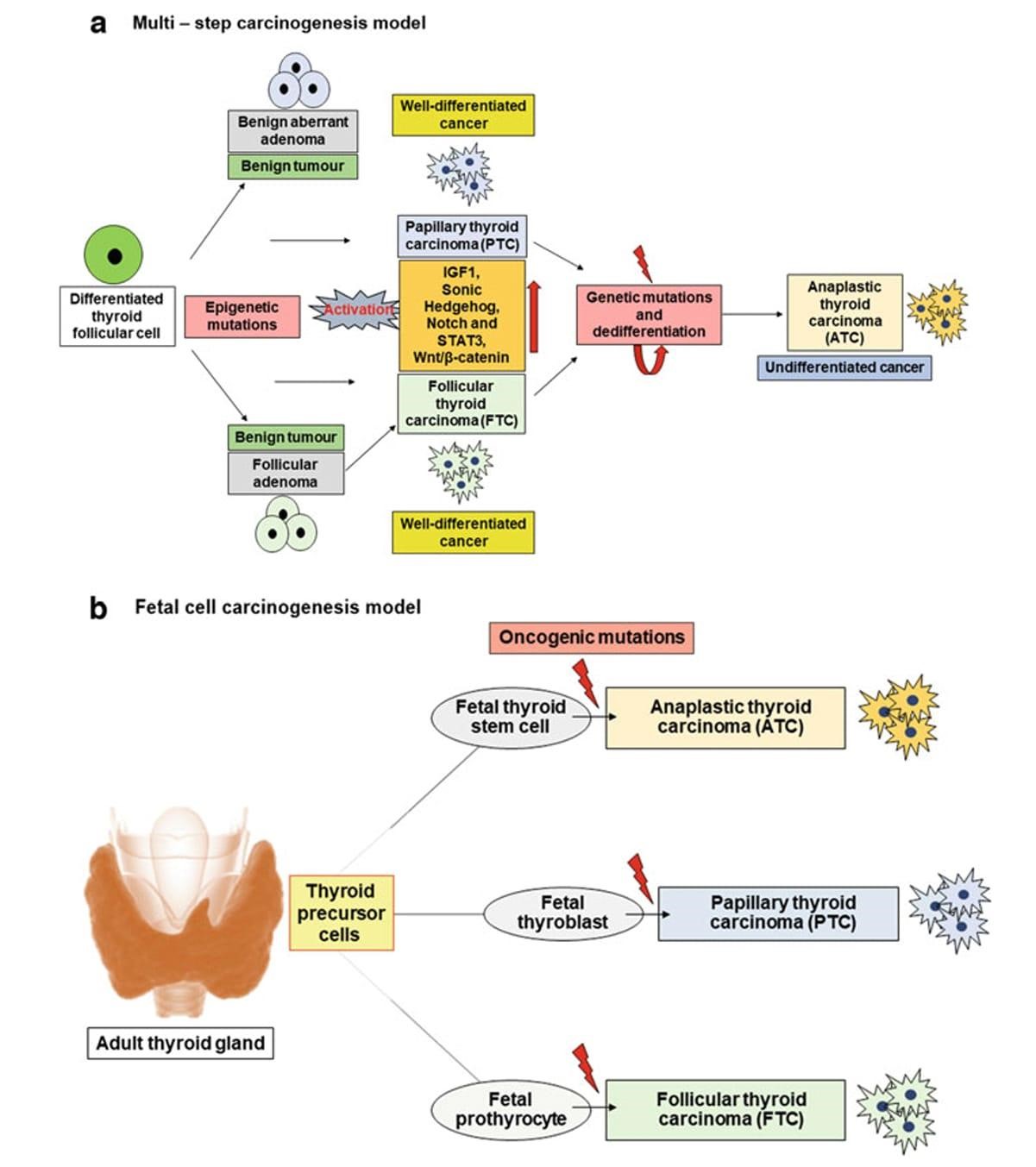
Şekil 2.2 Tiroid kanseri kök hücrelerinin (TCSC’ler) kökeni. TCSC’lerin kökenine ilişkin iki modeli, yani çok aşamalı karsinogenez modeli ve fetal hücrekarsinogenez modelini açıklamak için farklı teoriler öne sürülmüştür. (a) Çok aşamalı karsinogenez modeli—Bu modeli açıklamak için teori, farklılaşmış tiroid foliküler hücresinin, normal farklılaşmış tiroid hücrelerinin ilerlemesini aktif olarak destekleyen çeşitli anahtar sinyal yollarının serbestleştirilmesine ve aktivasyonuna yol açan çeşitli faktörler nedeniyle epigenetik değişikliklere uğradığını varsaymaktadır. tiroid kanseri hücrelerine. Oluşan iç tümör kanserli veya foliküler adenom gibi iyi huylu olabilir. Bununla birlikte, ilk tümördeki anahtar sinyal yollarının anormal aktivasyonu, onu hızlı bir şekilde ilerlemeye ve foliküler veya papiller tiroid karsinomu (FTC/PTC) dahil olmak üzere farklılaşmış bir karsinom haline gelmesine neden olabilir. Ayrıca, bu farklılaşmış kanserler, anaplastiktiroid karsinomu (ATC) adı verilen agresif ve farklılaşmamış bir kanser formuna dönüşmek için genetik mutasyon(lar) ve farklılaşmadan geçebilir. (b) Fetal hücre karsinogenez modeli—Bu modeli açıklamak için teori, yetişkin bir tiroid bezinin normal fizyolojik süreçlerini düzenleyen farklı tipte tiroid bezi hücrelerinin olduğunu varsayar. Fetal tiroid kök hücrelerinin öncüleri, fetal tiroblastlar ve protirositler. Bu üç hücre tipi spontan genetik mutasyonlara uğrayabilir ve üç farklı tiroid karsinomu tipine dönüşebilir. Fetal tiroid kök hücrelerinde onkojenik bir vuruş ATC’ye ilerleyebilir ve fetal tiroblastlarda ve protirositlerde daha fazla mutasyon sırasıyla papiller ve foliküler tiroid kanserlerini oluşturabilir.
2.3.2 TCSC’lerin Tanımlanması, İzolasyonu ve Karakterizasyonu
Diğer heterojen popülasyonlar arasında tiroid CSC’lerinin tanımlanması ve izolasyonunda farklı yöntemler kullanılmaktadır. Shimamura et al. [83], çalıştıkları sekiz farklı tiroid kanseri hücre dizisinde ortak CSC’lerin olmadığını gösterdiler. Buna rağmen, CD326 (EpCAM olarak da adlandırılır), 166, 133, 117, 90, 44, 44v, 24, 15 (SSEA-1 olarak da adlandırılır), 13 ve ALDH gibi potansiyel olarak tanımlanan çeşitli başka belirteçler vardır. tiroid CSC’lerini karakterize etmek için adaylar vardır ve izolasyon ve karakterizasyonunda yer alan çeşitli teknikler vardır [84].
FACS, hücre yüzeyi belirteçlerini kullanarak heterojen bir hücre popülasyonundan farklı bir hücre tipinin izolasyonunda kullanılan en yaygın tekniktir [85]. Buna ek olarak, Hoechst boya akışı, hücrelerin (farklılaşmış hücreler) yan popülasyonunu dışlamak için de kullanılır, çünkü bu hücreler ABCG2 ilaç taşıyıcısını kullanarak DNA bağlayıcı boya Hoechst 33342’yi dışlayabilir. Ancak bu tekniğin, boyanın toksisitesi nedeniyle kendi sınırlamaları vardır. FACS ve Hoechst boya akışından sınıflandırılan ve ayrılan hücreler ayrıca in vitro ve in vivo çalışmalara tabi tutulur ve hücreler, bağışıklığı baskılanmış farelere enjekte edildiğinde in vitro sferoidler ve tümörler oluşturabildi [86]. ALDH, kemoterapiye karşı direnç geliştirmede ve tiroid tümörlerinin metastatik potansiyelini artırmada kilit rol oynar.
Kanser ilerlemesi sırasında çeşitli zaman noktalarında ifade edilen spesifik biyobelirteçler vardır. MDR1, ATP bağlayıcı kaset süper ailesi G üyesi 2 (ABCG2) ve çoklu ilaç direnci ile ilişkili protein 1 (MRP1), hücrelerin izole edilebileceği ve terapötik dirençli tümörler arasında karakterize edilebileceği diğer biyobelirteçlerdir. İnce iğne aspirasyon (FNA) biyopsisi kullanılarak, çoklu ilaca dirençli tümörlerin saptanması için tümör hücreleri bu biyobelirteçler için analiz edilir [86]. Bir in vitro çalışmada, düşük konsantrasyonlarda antikanser ilacı doksorubisin içeren uzun süreli HTh74R hücre çizgisi kültürü, ana hücre çizgisine kıyasla bu hücrelerde direnç gelişimi ile sonuçlanmıştır. İlginç bir şekilde, ebeveyn hücre çizgisi, bu çoklu ilaca dirençli biyobelirteçlerin anlamlı bir ifadesini göstermedi [87]. Diğer belirteçler arasında, CD15, 24, 44 ve 133, tiroid CSC’lerinin saptanmasında yaygın olarak kullanılmaktadır. CD15/SSEA-1, SSEA-1+ hücreleri ağırlıklı olarak bu geçiş sırasında eksprese edildiğinden EMT için bir işaretleyici olarak kullanılır. CD24+ ve CD44+ hücreleri, sferojenik/tümörojenik potansiyelden sorumludur ve agresif tiroid kanseri hücre hatlarının çoğunda önemli ölçüde eksprese edilmiştir. CD133+ hücreleri, tiroid CSC’lerinin kendi kendini yenileyebilmesinden ve kemorezistanstan sorumlu olan yüksek düzeyde içsel kök genleri (Oct-4, Sox2 ve Nanog) ve ilaca dirençli genleri (ABCG2, MDR1 ve MRP) ifade eder [88].
2.3.3 Tiroid Kanserinde Sinyal Verme, Kendini Yenileme, Metastaz ve Farklılaşma
İnsülin benzeri büyüme faktörü 1 (IGF1), Hedgehog, Notch ve Wnt/β-katenin gibi çoklu sinyal mekanizmaları, tiroid karsinomlarının başlamasını ve ilerlemesini destekleyen tiroid CSC’lerinin korunmasında çok önemli bir rol oynar. Bu sinyal yolları, normal hücresel fizyolojinin korunmasından sorumludur; bununla birlikte, bu yolakların anormal aktivasyonu, CSC’lerin hayatta kalmasını ve dolayısıyla tümörlerin gelişimini ve ilerlemesini arttırır [89]. OCSC’lere benzer şekilde, çekirdek TCSC’lerin sinyal yolları henüz iyi anlaşılmamıştır. Bu nedenle, bu bölümde esas olarak Tiroid kanserindeki sinyal yolaklarını tartıştık.
2.3.3.1 Tiroid Kanserinde İnsülin Benzeri Büyüme Faktörü (IGF)1 Sinyal Yolu
IGF1 sinyal yolu, mitotik ve antiapoptotik özelliklerinden dolayı tiroid kanserinin büyümesini destekler. IGF1, çeşitli organlar tarafından üretilen ve metabolizma ve büyümede baskın rolü olan endojen bir hormondur [90]. Aksine, dolaşımdaki yüksek IGF1 seviyeleri, tiroid, meme ve prostat dahil olmak üzere çeşitli karsinom türleri ile yüksek oranda ilişkilidir. IGF1’in gerçekten farklılaşmış tiroid kanserlerinin oluşumunda rol oynadığı da iyi bilinmektedir. IGF1 ligandları ve reseptörleri (IGF1R), bu yolun hiperaktivasyonuna yol açan tiroid kanseri hücrelerinde aşırı eksprese edilir [91]. Normal durumda, ligandın reseptöre bağlanması, aşağı akış sinyal moleküllerini aktive eder ve tirosit proliferasyonunu uyarır. Aksine, bu IGF1 sinyal yolunun değiştirilmiş regülasyonu, tirositlerin hızlı çoğalmasına, hücre bölünmesi sırasında hücresel kontrol noktalarından kaçmasına ve tiroid bezinde neoplazma oluşmasına neden olur. Ayrıca, IGF1R ve tiroid uyarıcı hormon (TSH) arasındaki çapraz konuşma, IGF ekseninin aktivasyonunu arttırır. Aslında, TSH’nin tümör başlatma potansiyeli, diğer büyüme faktörleri tarafından karşılanır, ancak IGF1, pro-tümörijenik etkiyi uyarır [92]. Ayrıca, PTC küreleri, IGFIR ve IGF1 / 2 ifadelerinde artış gösterdi ve ilginç bir şekilde, IGF1 yolunun aktivasyonu, sferoidlerin boyutunu ve sayısını arttırdı [93].
2.3.3.2 Tiroid Kanserinde Hedgehog Sinyal Yolu
Hedgehog (HH) sinyali, çeşitli kanserlerde kemo-direnç ve radyo-direncine katkıda bulunur ve bu sinyalleşme, tiroid CSC’lerinin korunmasında kritik öneme sahiptir [94]. Hedgehog sinyal yolu, SNAIL proteininin ekspresyonu yoluyla tiroid CSC’lerini yeniler ve ATC hücre hattında HH inhibitörlerinin kullanılması, CSC yenilenmesinin azalması nedeniyle kemoterapi ve radyoterapiye karşı artan hassasiyetle sonuçlandı [95]. Ayrıca, Hedgehog sinyalinin, çapraz konuşma mekanizması yoluyla AKT ve c-MET gibi farklı yolları aktive ederek tiroid kanserlerinin saldırganlığını arttırdığı gösterilmiştir [96].
2.3.3.3 Tiroid Kanserinde Notch ve JAK-STAT3 Yolları
Notch sinyalinin önemli hedef geni, bir bHLH transkripsiyonel baskılayıcısı olan Hes1, tiroidde önemli ölçüde eksprese edilir ve sodyum/iyodür semporterinin (NIS) ekspresyonunu düzenler [97]. Normal ve kanserli tiroidde farklı seviyelerde Notch sinyal genleri eksprese edilir. Tiroid kanserinde, NOTCH1 ekspresyonu, tümör alt tipleri arasında farklılık gösterir. NOTCH1 ekspresyonu, normal tiroid ve peritümöral dokularla karşılaştırıldığında insan PTC’lerinde (klasik ve foliküler varyantlar, mikrokarsinomlar) daha yüksekti [98]. Ancak, insan ATC’sinde NOTCH1 ekspresyonu azalmıştır [99]. Önemli olarak, Notch sinyal yolunun birkaç bileşeni, mikroarray analizi ile belirlendiği gibi insan PTC’sinde yukarı doğru düzenlenmiştir [100]. Ayrıca, Yamashita ve ark. [101], transgenik hayvanların yanı sıra insandan türetilen PTC numunelerinde NOTCH1 ekspresyonunun yukarı regülasyonunu gösterdi. İlginç bir şekilde, PTC hücrelerinin NOTCH1 veya GSI için siRNA ile tedavisinin hücre proliferasyonunu önemli ölçüde azalttığını ve apoptozu arttırdığını gösterdiler.
CD133+ ATC hücreleri, doku gelişimi ve homeostaz sürecini düzenleyen Janus Kinaz (JAK)-STAT3 yolunun aktivasyonunu gösterdi. JAK-STAT3 yolunun bazı işlevleri, hematopoez, bağışıklık gelişimi, meme bezi gelişimi ve laktasyon, adipogenez ve cinsel olarak dimorfik büyüme gibi en kritik işlevler dışında, çoğunlukla Notch sinyaline benzer. Shiraiwa et al. [102], ATC hücrelerinin bir STAT3 inhibitörü olan cucurbitacin I ile tedavisinin, in vitro tirosfer oluşturma yeteneğini ve çıplak farelerde tümör büyümesini baskılayarak, bu yolu terapötik hedeflerden biri olarak vurgulayarak gösterdi.
2.3.3.4 Tiroid Kanserinde Wnt/b-Catenin Sinyal Yolu
Sitoplazmada ve çekirdekte β-katenin’in daha yüksek ekspresyonu, tiroid karsinomları dahil olmak üzere karsinomların çoğunda gözlenir. APC ve AXIN1 gibi genlerin mutasyonu ve deregülasyonu ve sitoplazmada ve çekirdekte β-katenin birikimi, iyi farklılaşmış PTC ve FTC’de görülür. Wnt/β-katenin yolu tiroid CSC’lerinin hayatta kalmasını desteklediğinden, tiroid kanseri nüksü ve metastaz oranlarının daha yüksek insidansı, bu spesifik yolun yapısal aktivasyonu ile pozitif olarak ilişkilidir. Ayrıca, E-kadherinin aşağı regülasyonu ile birlikte yolun sürekli aktivasyonu, farklılaşmamış tiroid tümörlerinin çoğunda kanser hücrelerinin artan göç kapasitesi ve metastaz ile önemli pozitif korelasyona sahiptir. Önemli olarak, Wnt/β-katenin yolu, tiroid kanseri saldırganlığında anahtar bir rol oynar [103]. Kanser saldırganlığı hakkında ek bilgi için “Bölüm. 8: CSC’ler ve Tümör Saldırganlığı” bu kitapta yer almaktadır.
2.3.4 TCSC’ye Özgü Terapötikler ve Sonuçlar
Tiroid kanserine özgü çeşitli biyolojik belirteçler kullanılarak TCSC’lerin tanımlanması ve izolasyonu, tümörü tamamen gerilemek ve tümörün nüksetmesini önlemek için çok sayıda terapötik hedefin keşfedilmesine yol açmıştır [104]. Yukarıda tartışılan konulardan, karsinogenez sürecinde değişen çoklu sinyal kaskadları ve genlerin olduğu açıktır. Küçük molekül inhibitörleri, blokerler, aptamerler ve koşullu nakavt stratejileri dahil olmak üzere çeşitli terapötik yaklaşımlar, şu anda TCSC’leri besleyen ve yönlendiren ve böylece tümörleri hedef alan farklı yolları kapatmak için kullanılmaktadır [105]. Mevcut tedaviler, TME’de sıkı bir şekilde kapsüllendiğinden TCSC’leri doğrudan hedeflememektedir. Kemo ve radyoterapiden sonra tümörün nüks etmesinin kritik nedeni, bu tedavilerin tedavi sırasında CSC’leri hedefleyememesidir. CSC’ler heterojen hücre popülasyonunu yeniden doldurur ve primer bölgede tümörün yeniden büyümesi meydana gelir, bu da bu tedavilere karşı dirençle birlikte daha da karmaşık hale gelir [106].
2.3.5 Tiroid Kanserleri için Klinik Araştırmalar
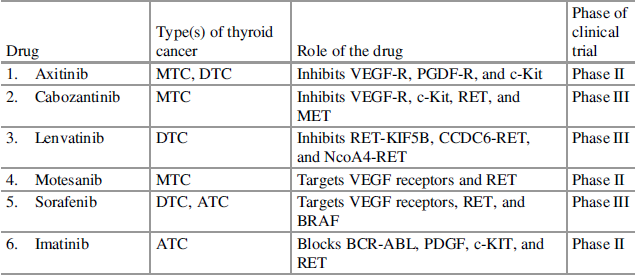
Tiroid kanseri, endokrin kanserler arasında en çok ölüme neden olan korkunç kanserlerden biridir. Hastalık çoğunlukla asemptomatik olduğundan veya sadece lokal ileri veya metastatik evrede kendini göstermeye başladığı için hızla ilerler ve tedavi rejimine karar vermeyi zorlaştırır [107]. Tümör rezeksiyonu, bu karsinomun erken evrelerinde yapılan ve ardından geleneksel kemo ve radyoterapinin izlediği yaygın klinik prosedürlerden biridir. Ancak yine de, TCSC’lere bağlı olarak tiroid kanseri nüksü ve kemorezistans olasılığı yüksek olduğundan, hastanın hayatta kalma oranı düşmektedir. Tümör gelişiminde CSC’lerin doğasına ilişkin mevcut görüşler, tümörün tamamen gerilemesi için TCSC’leri hedeflemede ve nüks şansını frenlemede çeşitli araştırma kanalları açmıştır [108]. Daha önce tartışıldığı gibi, çoklu sinyal kaskadları ve çeşitli sayıda gen, tiroid kanserinin başlaması ve ilerlemesinde rol oynar. Bu nedenle, bu önemli genleri hedeflemek, sonunda yolu kapatacak ve terapötikler geliştirmek için bir strateji olabilir. Yolları hedeflemek için araştırılan farklı bileşik türleri vardır ve bunların çok azı tiroid kanseri tedavisinde umut verici sonuçlar vermiştir. Klinik deneylerde test edilen ilaçlar Tablo 2.2’de verilmiştir [109-111].
Tablo 2.2 Tiroid kanserinin farklı sinyal yolu inhibitörlerini kullanan klinik araştırmalar.
2.4 Melanom Kanseri Kök Hücreleri (MCSC’ler)
Melanom, cilt kanserinin ciddi alt tiplerinden biridir. Melanom kanseri kök hücrelerinin (MCSC’ler) keşfi, araştırmacıların normal melanositlerin melanomaya tümörijenik dönüşümüne yol açan temel sinyal mekanizmalarını daha iyi anlamalarına yardımcı oldu (Şekil 2.3). MCSC’ler veya melanoma başlatıcı hücreler, Fang grubu tarafından, CD20+ hücrelerinin kök hücre benzeri özelliklere sahip metastatik insan melanomlarından izole edildiği küre oluşturan tahlil kullanılarak keşfedildi [112]. Daha sonra Schatton ve ark. [113] MCSC popülasyonunun ABC taşıyıcı ABCB5’i ifade ettiğini bildirdi. Hakim teori, MCSC’lerin terapötik olarak hedeflenmesinin, tümörün melanomlara ilerlemesini ortadan kaldırabileceğini öne sürmektedir [114]. Melanomlarda MCSC’lerin spesifik olarak hedeflenmesi, spesifik belirteçlere sahip MCSC’lerin sayısının düşük olması, MCSC popülasyonundaki intratümöral ve intertümöral heterojenlik, MCSC’lerin immün kaçınma ve kemo direnç özellikleri nedeniyle zordur. Moleküler biyolojinin, sinyal mekanizmalarının ve altta yatan epigenetik düzenlemenin doğru bir şekilde anlaşılması, MCSC’lerin spesifik olarak hedeflenmesini ve dolayısıyla etkili melanom hedefli terapötiklerin geliştirilmesini kolaylaştıracaktır [115].
2.4.1 MCSC’lerin Kökenleri ve İşaretleri
MCSC’ler için birkaç biyobelirteç bildirilmiştir, ancak CD271 (nöral krest sinir büyüme faktörü reseptörü) en önemli belirteçtir [116]. 3D kültür koşullarında öne çıkan diğer MCSC işaretleri Nanog, Sox-10 ve Oct-3/4 transkripsiyon faktörleri, CD20 ve CD133 hücre yüzeyi reseptörleri ve ALDH1’dir. ABCB1, ABCB5 ve ABCG2’nin de 3D melanosferleri ve hücre dizilerini kullanan bir çalışmada MCSC’leri işaretlediği bildirildi [117]. MCSC’ler için bir diğer önemli belirteç H3K4 demetilaz JARID1B’dir. Musashi-1 (Msi-1), Nestin, CD30 ve Tenascin-C, sıklıkla yüksek oranda proliferatif JARID1B+ melanom hücreleri ile ilişkilendirilen biyobelirteçlerdir [118, 119]. PD-1, VEGFR1 ve CXCR6, kendini yenileme, bağışıklıktan kaçınma ve vasküler taklit ile ilgili bazı ek yüzey belirteçleridir [120].
2.4.2 MCSC’lerin Tanımlanması, İzolasyonu ve Karakterizasyonu
MCSC’ler, melanomda kendini yenileme, tümör başlangıcı ve metastaz veya ilaç direnci gösteren son derece küçük bir hücre alt popülasyonudur. Bu nedenle, MCSC’lerin izolasyonu ve karakterizasyonu, melanomun gelişimini, metastazı, nüksetmesini, ilaç direncini ve terapötiklerini anlamak için esastır. Bir melanomdaki çok az sayıda MCSC ve sınırlı miktarda mevcut melanom doku biyopsi materyali, MCSC’lerin izolasyonunu ve karakterizasyonunu melanom araştırmalarında son derece zorlu bir görev haline getirmiştir. Bu nedenle, MCSC’lerin izolasyonu ve karakterizasyonunda birçok farklı teknik denenmiş ve kullanılmıştır [121, 122]. Doğrudan etiketleme tekniğinde, ABC taşıyıcıları, CD20, CD133 (prominin-1), CD271 (NGFR/p75 nörotrofin reseptörü), JARID1B, vb. gibi çeşitli hücre yüzeyi işaretleyici antijenlerine bağlanmak için floresan etiketli spesifik antikorlardan oluşan bir kokteyl kullanıldı ve daha sonra MCSC’ler için yüksek oranda zenginleştirmek üzere FACS’ye göre sıralandı. Kullanılan başka bir yöntem, benzersiz bir çıkarma veya eleme yaklaşımıyla birlikte manyetik boncuk hücre sıralama tekniğiydi. Bu teknikte, kırmızı kan hücreleri (RBC’ler), endotel hücreleri vb. dahil olmak üzere hematopoietik hücrelere ve bunların hücresel döküntülerine bağlanmak, MCSC’lerden istenmeyen kirleticileri uzaklaştırmak için bir antikor kokteyli kullanıldı, bu da aşağı akış uygulamaları için MCSC’lerin zenginleştirilmesini ve analizini sağladı [123].
Şekil 2.3 Melanom kanseri kök hücreleri (MCSC’ler) sinyal yolları ve olası terapötik hedefler. Hedgehog (HH), Patch (PTCH) reseptöre bağlanır ve GLI1/2 nükleer translokasyonunu ve ardından melanomda transkripsiyon faktörü E2F1 ekspresyonunun transkripsiyonel aktivasyonunu indükler. E2F1, sırayla, p53’e bağlı apoptozun inhibisyonuna ve melanomun ilerlemesine yol açan p53 (iASPP) ekspresyonunun apoptoz uyarıcı proteininin inhibitörünü destekler. BRAF (V600E) ve NRAS’taki (Q61K) mutasyonlar, MYC aracılığıyla miR-146a’yı indükler, bu da NUMB’nin aşağı regülasyonu yoluyla Notch sinyalini etkinleştirir. DLL, NOTCH’e bağlanır ve NICD’nin γ-sekretaz tarafından bölünmesine yol açar. NICD nükleer translokasyona uğrar, ardından CD133’ün transkripsiyonel aktivasyonu gelir. Daha sonra, p38 MAPK yolu aracılığıyla CD133, aktivatör protein-1 (AP-1) DNA bağlanma aktivitesini spesifik olarak düzenler ve melanom ilerlemesini destekleyen çeşitli hücresel fonksiyonların modülasyonuna yol açar. JNK/c-Jun yolu yoluyla Wnt, aktivasyona yol açabilir. melanom anjiyogenezini ve metastazı teşvik eden AP-1 tarafından düzenlenen genlerin FZD reseptörü, DLL4, NOTCH, CD133, CD20 veya ABCB5’e karşı hedeflenen mAb’ler, MCSC’leri ve MCSC aracılı melanom ilerlemesini inhibe eder. Notch [DAPT, Honokiol ve Andrographolide (Andro)], Hedgehog (siklopamin) ve Wnt sinyali (XAV939) dahil olmak üzere spesifik yolların küçük molekül bazlı inhibisyonu, MCSC’leri ortadan kaldırır. İnsülin büyüme faktörü reseptörü 1 (IGF1), reseptörü (IGF1R) ile etkileşime girer ve hipoksi ile indüklenebilir faktör 1α (HIF1α) translokasyonuna ve DNA’ya bağlanmasına yol açan ERK ve p38 fosforilasyonunu uyarır, bu da melanom sapı benzeri özelliklerin korunmasını arttırır. SMAD’ler ile birlikte dönüştürücü büyüme faktörü-β (TGF-β), epiteli mezenkimal geçişe (EMT) aktive eder ve ardından melanom hücrelerinin göçünü indükler. Benzer EMT ve göçmen fenotip, melanomda PI3K/AKT sinyal yolunun trombosit kaynaklı büyüme faktörü (PDGF) aracılı aktivasyonu tarafından da indüklenir. Monoklonal antikorlar, şekilde gösterildiği gibi melanomu hedeflemek için spesifik olarak da kullanılabilir. DAPT: tert-butil(2S)-2-[[(2S)-2-[[2-(3,5-diflorofenil)asetil]amino]propanoil]amino]-2-fenilasetat; Andro: 3-[2-[dekahidro-6-hidroksi-5-(hidroksimetil)-5,8a-dimetil-2-metilen-1-naftalenil]etiliden]dihidro-4-hidroksi-2(3H)-furanon; Honokiol: 2-(4-hidroksi-3-prop-2-enilfenil)-4-prop-2-enilfenol); Siklopamin: (20R,3S,30R,30aS,60S,6aS,6bS,70aR,11aS,11bR)-1,2,3,30a,4,40,50,6,60 ,6a,6b,7,70, 70a,8,11,11a,11b-oktadekahidro-30,60,10,11b-tetrametil-spiro[9H-benzo[a]floren-9,20(30H)-furo[3,2-b]piridin]- 3-ol; XAV939: 2-[4-(triflorometil)fenil]-7,8-dihidro-5h-tiyopirano[4,3-D]pirimidin-4-ol
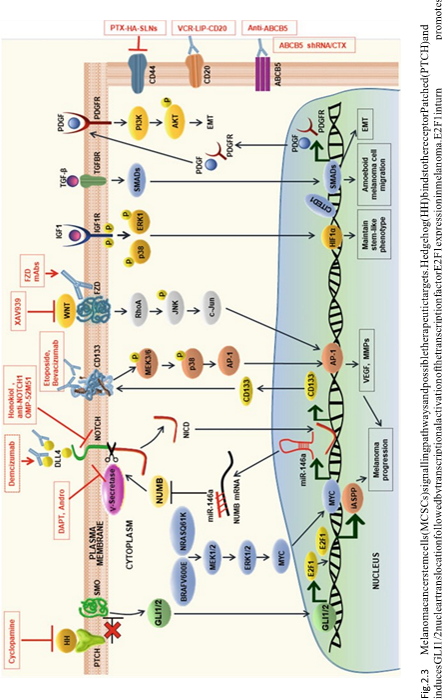
2.4.3 MCSC’leri Düzenleyen Sinyal Yolları
Melanom, cilt kanserleri arasında en agresif ve öldürücü alt kategoridir ve buna karşı tedavi belirsizliğini korumaktadır. MCSC’lerdeki sinyal yolları, melanomların tümörijenezi ile ilişkili moleküler mekanizmaları incelemek için yoğun bir şekilde araştırılmaktadır. MCSC’ler, kendini yenileme ve farklılaşmayı düzenlemede normal kök hücrelere benzer ortak embriyonik kök hücre yollarını paylaşır. TGF-β, MCSC’lerin plastisitesini korur. TGF-β, daha sonra tip I TGF-β reseptörüne (TGFBR1) bağlanan ve bir heterodimerik kompleks oluşturan tip II TGF-β reseptörüne (TGFBR2) bağlanır. Aktive edilmiş TGFBR1, TGF-β-yanıt veren genlerin aktivasyonu ile sonuçlanan olaylar dizisi ile sonuçlanan SMAD proteinlerini fosforile eder (Şekil 2.3). Kirpi (Hh) yolu, melanomun başlaması ve ilerlemesinde önemli bir rol oynar [124] ve bu yolun inhibisyonu, ALDH+ MSCS’nin kendi kendini yenilemesini baskılar [125]. GLI1/2, MCSC hücre proliferasyonu ve melanomlara ilerleme için kritik olan E2F1’in transkripsiyonunun düzenlenmesinde rol oynar [126]. MCSC’ler, Wnt reseptörünün artmış ekspresyonunu gösterir ve sıklıkla artan metastaz ile ilişkilidir [127].
Notch sinyali, MCSC proliferasyonunda önemli bir rol oynar. Kumar et al. [128], CD133+ MCSC popülasyonunda artan Notch1 aktivasyonu ve sinyalleşme gösterdi. Notch sinyal yolunun γ-sekretaz ve TNF-a dönüştürücü enzim (TACE) inhibitörleri ile inhibisyonu, NICD2 ve Hes’nin aşağı regülasyonuna yol açtı ve bu da MCSC’lerin proliferasyonunu inhibe etti [129, 130]. Notch4, MCSC’lerin istilasından ve metastazından sorumludur [131]. TGF-β ve PI3K/AKT yolakları dahil olmak üzere çeşitli sinyalleşme basamaklarının MCSC’lerde EMT’yi indüklediği rapor edilmiştir [132]. MCSC’lerde ve tümörün melanomlara ilerlemesinde temel rol oynayan tüm anahtar moleküler sinyal yollarının özeti Şekil 2.3’te gösterilmektedir.
2.4.4 MCSC’ye Özel Terapötikler ve Sonuçlar
Cerrahi rezeksiyon, radyo ve kemoterapi ve immünoterapi, melanom için şu anda mevcut tedavi seçenekleridir. Melanom öldürücü olabileceğinden, melanom hastalarını tedavi etmek ve iyileştirmek için MCSC’ye özgü etkili hedefleme stratejileri geliştirmeye acil bir ihtiyaç vardır. Monoklonal antikorlarla MCSC’leri (CD133, CD20, ABCB5, CD271 ve ALDH1 belirteçlerini ifade eden) hedefleyen bir strateji, melanom büyümesini önemli ölçüde azalttıkları için bir miktar başarı gösterdi. Bevacizumab ve etoposid ile kombinasyon tedavisini içeren başka bir tedavi, apoptozu önemli ölçüde indükleyebildi ve CD133+ MCSC’lerin küre oluşturma yeteneğini ortadan kaldırdı [133, 134]. Ek olarak, DAPT (Notch inhibitörü), siklopamin (Hh sinyal inhibitörü) ve XAV939 (Wnt sinyal inhibitörü) gibi inhibitörlerle MCSC’ye özgü sinyal yollarının (Şekil 2.3) hedeflenmesi, melanom hastalarını tedavi etmek için alternatif stratejiler olarak hizmet edebilir [135, 136].
2.4.5 Melanomlar için Klinik Araştırmalar
Melanomlar için klinik deneylerde olan ilaçlar şunlardır: (1) XmAb20717 (Aşama I), (2) entrectinib (Aşama I/II), (3) encorafenib (Aşama I/II), (4) binimetinib (Aşama I), (5) DCC-2618 (Aşama I), (6) LGK974 (Aşama I), (7) Nivolumab (Aşama II), vb. Son birkaç yılda FDA onaylı tedavilerde (dakarbazin) bazı ilerlemeler olmasına rağmen , kobimetinib, pembrolizumab, vemurafenib, tipifarnib, vb.) melanomlar için, önümüzdeki yıllarda melanomları tedavi etmek için immünoterapilerde daha etkili ve daha büyük ilerlemeler beklenmektedir. Okuyucu, ek bilgi için bu konudaki son makalelere başvurabilir [137, 138].
2.5 Pankreas Kanseri Kök Hücreleri (PCSC’ler)
Pankreas kanseri kök hücreleri (PCSC’ler), ksenograft fare modeli kullanılarak Li grubu tarafından tanımlandı [16]. Normal kök hücreler gibi, PCSC’ler de kendini yenileme ve farklılaşma potansiyeli gösterir. PCSC’ler tümörün yalnızca çok küçük bir kısmını temsil eder (pankreatik kanser hücre popülasyonunun %0.2-0.8’i) ve benzersiz bir hücre yüzeyi işaretleyici imzası (CD44+CD24+ESA+) temelinde toplu tümör popülasyonundan ayırt edilebilirdi [139] . Paralel bir çalışmada, Hermann grubu CD133+’yı PCSC’ler için ek bir hücre yüzeyi belirteci olarak tanımladı ve ayrıca CD133’ün CD44+CD24+ESA+ eksprese eden pankreas kanseri hücreleriyle %14 örtüştüğünü gösterdi [140]. PCSC’ler tümörün küçük bir bölümünü oluştursa da, çoğunlukla pankreas kanserlerinin invaziv ve metastatik potansiyellerine ve geleneksel kanser tedavilerine direnç veya tedaviden sonra kanser nüksetmesine katkıda bulunurlar.
2.5.1 PCSC’lerin Kökenleri ve İşaretleri
PCSC’lerin tümör başlatma ve büyümedeki etkinliğini değerlendirmek için, PCSC’ler ya akış ya da manyetik olarak sıralandı ve ardından bağışıklığı baskılanmış farelere enjekte edildi [141]. CD133, CD44 ve CD24, PCSC’lerin en yaygın olarak kabul edilen belirteçleridir. OCT4, cinsiyet belirleyici bölge Y-box 2 (SOX-2), tirozin-protein kinaz KIT (c-KIT) veya CD117, homeobox protein NANOG, ATP bağlayıcı kaset (ABC) alt ailesi B üye 1 gibi başka işaretler de vardır. (ABCB1), ABC alt ailesi G üye 2 (ABCG2), CD3, integrin α6β4, claudin-7, epitelyal spesifik antijen (ESA), Nodal/Activin, doublecortin ve CaM kinaz benzeri 1 (DCLK1), nestin, CXC motif kemokin reseptör tip 4 (CXCR4) ve lösin açısından zengin tekrar içeren G-protein kenetli reseptör 5 (LGR5) [142]. Ek olarak, ALDH1’in PCSC’lerin kökünü işaret ettiği bildirilmektedir ve ALDH+ hücrelerinin, ALDH hücrelerinden daha fazla tümörijenik potansiyele sahip olduğu bildirilmektedir. Ayrıca, CD133+/CXCR4+ PCSC’lerin gelişmiş invazivlik sergilediği gösterilmiştir [143]. Şimdiye kadar birçok farklı PCSC belirteci keşfedilmiş olsa da, bir tümördeki tüm PCSC’leri tespit etmek için bir veya bir grup benzersiz belirteç hala eksiktir. Bununla birlikte, CD24+/ CD44+/ESA+/CD133+/CXCR4+ ve ALDH1high, PCSC popülasyonunu “toplu pankreas kanserinden” zenginleştirmek için kullanılan en yaygın kabul gören belirteçlerdir.
2.5.2 PCSC’lerin Tanımlanması, İzolasyonu ve Karakterizasyonu
PCSC’leri karakterize etmek için, ilk olarak tip IV kollajenaz ve dispazdan oluşan ayrışma tamponu ile inkübe edilerek hasta tümör doku örneklerinden izole edildi ve daha sonra, tümör hücrelerini içeren sindirilmiş karışım, bir ficoll yoğunluk gradyanında [144] santrifüjlü ayırmaya tabi tutuldu. Daha sonra, PCSC’ler, FACS [145] tarafından birkaç PCSC belirteci (örn., ABCB1, CD24, CD44, CD133, CXCR4, DCLK1, EpCAM ve OCT4) kullanılarak gradyan hücre fraksiyonundan zenginleştirildi. CD44 ve CD24 gibi hücre yüzeyi belirteçlerini ifade eden PCSC’lerin morfolojisi pankreas kanserinden farklıdır ve PCSC’lerin karakterizasyonu için kullanılmıştır [146]. Bu protein belirteçlerine ek olarak, PCSC’lerin ek karakterizasyonu için pankreas kanseri sapına özgü miRNA belirteçleri (miR-17-92, miR-335, miR-1181 ve miR-1246) kullanıldı [141].
2.5.3 PCSC’leri Düzenleyen Sinyal Yolları
Normal kök hücrelerdeki sinyal yolları ve bunların karmaşık etkileşimleri üzerine yapılan çalışmalar, PCSC’lerdeki hücresel sinyal mekanizmalarının moleküler biyolojisini anlamak için bir çerçeve sağlamıştır. PCSC popülasyonunun korunmasını düzenleyen iyi çalışılmış sinyal mekanizmalarından bazıları Wnt/β-katenin, Hedgehog, NF-κB, Notch ve PI3K/AKT/mTOR yollarını içerir [146]. PCSC’lerde farklı sinyal yollarını inhibe eden genel olarak kullanılan bileşiklerin bir listesi Şekil 2.4’te gösterilmektedir.
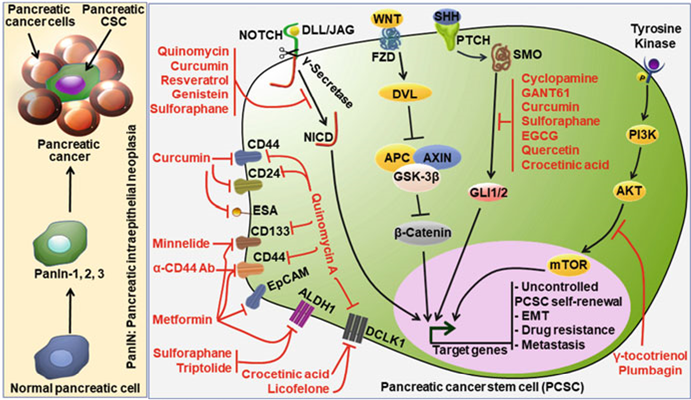
Şekil 2.4 Şematik gösterim, normal hücrelerin pankreatik intraepitelyal neoplaziye (PanIN) ve pankreas tümörüne adım adım ilerlemesini ve PCSC’leri düzenleyen yolları gösterir. Soldaki şekil: Pankreas kanserinin ilerlemesini gösteren bir model. Normal epitel hücrelerinin kademeli olarak farklı PanIN derecelerine ilerlemesi. PanIN-1 en düşük derecedir ve hücre polaritesinin kaybı, hücrelerin kanal lümenine yayılması ve önemli nükleer anormallikler ile karakterize edilen en yüksek dereceli PanIN-3 lezyonuna kadar uzanabilir. Sağdaki şekil: PCSC’leri çalıştıran potansiyel sinyal yolları ve bunun hedeflenebilir hücre yüzeyi işaretleri şematik şekilde gösterilmektedir. Bir inhibitör listesi (kırmızı ile gösterilmiştir), PCSC sinyalizasyonu ile ilişkili farklı yolları hedeflemede özel bir rol oynar ve potansiyel terapötiklerdir.
2.5.3.1 PCSC’lerde Wnt/b-Catenin Sinyal Yolu
Wnt/β-katenin sinyal yolu, pankreas tümörü oluşumunda ve terapötik dirençte önemli bir rol oynar. Wnt sinyal yolları ya β-katenin bağımlı (yani kanonik) veya β-katenin bağımsız (yani kanonik olmayan) olabilir. Kanonik Wnt/β-katenin sinyalinin anormal aktivasyonu pankreas adenokarsinomuna katkıda bulunur [148]. WNT ligandları mevcut olduğunda, Wnt-reseptör kompleksine bağlanırlar. Wnt-reseptör kompleksi, Frizzled (FZD) familyasının yedi transmembran reseptöründen ve tek geçişli düşük yoğunluklu lipoprotein reseptörü ile ilgili protein 5/6’dan (LRP5/6) oluşur. WNT ligand-reseptör kompleksi daha sonra AXIN, APC ve GSK-3β içeren yıkım kompleksi ile etkileşime girerek β-katenin aktivitesinin baskılanmasına yol açarken, AXIN bağlayıcı molekül Disheveled (DVL) β-katenin fosforilasyonunu bastırır (Şekil 1a). 2.4). Bu, β-katenin birikimine ve nükleer translokasyona, ardından TCF/LEF transkripsiyon faktörleri ailesine bağlanmaya ve tümörigeneze yol açabilen hedef genlerin aktivasyonuna neden olur (Şekil 2.4). Bununla birlikte, Wnt ligandlarının yokluğunda, β-katenin, serin (Ser) ve treonin (Thr) amino asit kalıntılarında, kazein kinaz 1 (CK1) ve GSK3β tarafından fosforile edilerek APC ve axin ile bir kompleks oluşturur ve yıkıma yol açar. β-katenin [149]. Wnt genlerinin ifadeleri, pankreas tümör hücrelerinde yukarı doğru düzenlenir. Bu nedenle, PCSC’lerin çoğalmasını azaltmak ve pankreas kanserlerini hedeflemek için kullanılabilecek yeni Wnt yolu inhibe edici moleküller geliştirmek için daha fazla çalışma garanti edilir.
2.5.3.2 PCSC’lerde Hedgehog Sinyal Yolu
Hedgehog (HH) yolu, insan PCSC’lerinin korunmasında kritik bir rol oynar. Pankreas kanserinde Hh sinyalinin anormal aktivasyonu bildirilmiştir [149]. HH sinyali için Hint (I), Desert (D) ve Sonic (S) HH olmak üzere üç ligand vardır. Bu ligandlar Patched (PTCH1 ve 2) adı verilen reseptörlere bağlanır. HH’nin reseptörüne bağlanması, Pürüzsüzleştirilmiş (SMO) adlı yedi transmembran proteinin aktivasyonunu inhibe eder, bu da GLI proteinini çekirdeğe yer değiştirmesi için aktive eder (Şekil 2.4). Lee et al. [150], CD44+CD4+ESA+ PCSC’lerin normal pankreas epitel hücreleri veya CD44 CD24ESA pankreas kanseri hücreleri ile karşılaştırıldığında 46 kat artmış SHH transkript ekspresyonu gösterdiğini bildirdi. Ayrıca, HH ligandlarının siklopamin (Hh antagonisti) ile inhibisyonu, metastazın inhibisyonuna yol açar (Şekil 2.4). Benzer şekilde, inhibitör IPI-269609 ile tedavinin (Şekil 2.4’te gösterilmemiştir) insan pankreas adenokarsinom hücre dizilerinin metastazını azalttığı rapor edilmiştir [151].
2.5.3.3 PCSC’lerde Notch Sinyal Yolu
Notch sinyali, hücre-hücre etkileşimi, kök hücre bakımı ve farklılaşması yoluyla hücre kaderinin belirlenmesinin düzenlenmesinde kritik bir belirleyicidir. Notch yolunun hiperaktivasyonu, pankreas adenokarsinomunda CSC’lerin kendi kendini yenilemesinin artmasıyla sonuçlandı [152]. Notch sinyali, dört NOTCH (NOTCH1–4) membran bağlantılı reseptör proteininden herhangi biri, beş kanonik transmembran ligand ailesi üyesi, Delta benzeri (DLL1, DLL3, DLL4) ve Jagged-1 (JAG1) ile etkileşime girdiğinde açılır. , JAG2). NOTCH reseptörü ve ligand arasındaki etkileşim, bir disintegrin ve metalloproteaz alanı (ADAM) metalloproteaz ailesinin bir üyesi olan TNF-a-dönüştürücü enzim (TACE) tarafından NOTCH reseptörlerinin proteolitik bölünmesine yol açan konformasyonel değişiklikleri indükler (Şekil 4’te gösterilmemiştir). 2.4) ve γ-sekretaz (Şekil 2.4). Bölünme, NOTCH’nin (NICD) hücre içi alanını serbest bırakır, ardından nükleer translokasyon ve ardından hedef genlerin aktivasyonu; Hey ve Hes, DNA bağlayıcı protein CSL (RBP-Jk) ve yardımcı aktivatörler ile heterodimerize olur. Pankreatik duktal adenokarsinom (PDAC) hücrelerinde Notch yolunun inhibisyonu, PCSC yüzdesinde ve genel tümör oluşumunda önemli bir düşüşe yol açtı. Kanser tedavisi için etkili bir NOTCH inhibitörü tabanlı strateji geliştirmede önemli bir zorluk, normal somatik kök hücre popülasyonunun sinyalleşmesini ve fizyolojisini bozmadan CSC’ye özgü hedefli bir NOTCH inhibisyonu geliştirmektir [152].
2.5.3.4 PCSC’lerde PI3K/AKT/mTOR ve Diğer Sinyal Yolları
Fosfoinositid 3-kinaz (PI3K)/RAC-alfa serin/treonin-protein kinaz (AKT)/rapamisinin memeli hedefi (mTOR) sinyal yolu (Şekil 2.4) PCSC proliferasyonunda önemli bir rol oynar. CD133yüksek PCSC’ler yüksek seviyelerde mTOR sinyali gösterdi; bununla birlikte, rapamisin (Şekil 2.4’te gösterilmemiştir) kullanılarak mTOR sinyallemesinin inhibisyonu, PCSC proliferasyonunu inhibe etti [153].
Yukarıda bahsedilen embriyonik sinyal ağlarına ek olarak, otofaji, interlökin 8 (IL8/CXCR1), çatal kafalı kutu proteini M1 (FOXM1) sinyallemesi, Nodal/Activin ve K-RAS/c- ile ilgili farklı sinyal yolları vardır. PCSC fonksiyonunun düzenlenmesinde yer aldığı bildirilen Jun-NH2-kinaz (JNK) sinyal yolları. Bununla birlikte, pankreas tümörü oluşumu sırasında karmaşık sinyal ağlarının önemini daha iyi anlamak için PCSC’lerde bu yollar arasındaki etkileşimleri açıklığa kavuşturmak ve araştırmak için gelecekteki araştırmalara ihtiyaç vardır [154].
2.5.4 PCSC’ye Özgü Terapötikler ve Sonuçlar
PCSC’leri hedeflemeyi içeren stratejilerin, kritik kök hücre sağkalımı ve işleyiş yollarının kesintiye uğramasını içerdiği gösterilmiştir [154]. İlaç direncinin üstesinden gelmek için TME’yi değiştirerek veya hücre yüzeyi belirteçlerini veya destekleyici vasküler nişin bozulmasını hedefleyerek pankreas kök hücre nişini hedeflemek, CSC’leri geleneksel sitotoksik radyo veya kemoterapinin etkilerine karşı duyarlı hale getirebilir ve/veya diğer CSC hedefli tedavilerin etkilerini güçlendirebilir . Şekil 2.4’te belirtilen çok sayıda klasik olmayan ilaç veya inhibitör veya diğer moleküllerin, PCSC’lerde çeşitli sinyal yolu bileşenlerini veya diğer gövde ile ilgili proteinleri değişen derecelerde inhibe ettiği gösterilmiştir.
2.5.5 Pankreas Kanserleri için Klinik Araştırmalar
Şu anda pankreas kanserini tedavi etmek için kullanılan birçok kemoterapötiklere ek olarak, pankreas kanseri tedavisi için test edilmekte olan, yakın zamanda geliştirilmiş birkaç yeni ilaç vardır. Güvenlik ve etkinlik açısından test edilmekte olan bu ilaçlar, ticari olarak sağlık hizmetlerine sunulmadan önce, ABD Gıda ve İlaç Dairesi (FDA) veya farklı ülkelerdeki diğer benzer kuruluşlar tarafından onaylanmadan önce çeşitli denemelerin farklı aşamalarından geçmek zorunda kalacaktır. Pankreas kanseri hastalarını tedavi etmek için sağlayıcılar. Pankreas kanseri için test edilen umut verici ilaç adaylarından bazıları (1) Gemsitabin/nab-paklitaksel (Aşama II), (2) GVAX pankreas aşısı (Siklofosfamid ile) +/ nivolumab ve urelumab (Aşama I ve II), (3) nal-IRI/5-FU/LV ve oksaliplatin (Faz II), (4) Pembrolizumab (Faz II), (5) Niraparib (Faz II), vb. [155, 156]. Ayrıca, pankreas kanserini hedeflemek için monoterapi veya kombinasyon tedavisi olarak potansiyel olarak kullanılabilecek yeni nükleik ilaçlar da, yeni nesil dizileme teknolojisine dayalı genetik tarama veya teşhis yardımıyla geliştirilmektedir.
2.6 Sonuçlar
Kanser, genetik, epigenetik veya inflamatuar faktörlerin değişiminin karsinogenez sürecine katkıda bulunabileceği karmaşık bir hastalıktır. Bozulmuş DNA onarım mekanizmaları veya baskılanmış bağışıklık sistemi veya onkogenlerin aktivasyonu veya tümör baskılayıcı genlerin inaktivasyonu, kanserin büyümesini başlatabilir veya teşvik edebilir. CSC’ler, kendilerine kendini yenileme kapasitesi ve yüksek plastisite sağlayan gövdeli olma özelliğine sahiptir. Bu nedenle, CSC’ler tümör agresifliği sergiler ve birincil tümörden metastazdan sonra, CSC’ler organlarda/dokularda uzak ikincil bölgelerde tümörleri başlatabilir ve ayrıca tedavi sonrası kanserin nüksetmesine neden olabilir. CSC’ler farklı tipte tümör hücrelerine farklılaşabilir ve bu, tümör heterojenliğine katkıda bulunur. Ayrıca, CSC’nin metastatik yayılma, tümör oluşumu ve tümör nüksetmesindeki rolü, Hedgehog, Notch, TGF-β ve Wnt/β-katenin gibi anahtar sinyal yollarının hiperaktivasyonuna atfedilir. CSC’ler bu sinyal yollarını kendilerini yenilemeleri ve hayatta kalmaları için kullanır ve bu nedenle bu yollar CSC’ler için kritiktir. Önemli olarak, bu hiperaktive edilmiş CSC sinyal yollarının, onkogenler ve tümör baskılayıcı genler dahil olmak üzere önemli genlerin ekspresyonunu ve işlevini değiştirdiği ve dolayısıyla tümör oluşumunu desteklediği gösterilmiştir. CSC belirteçlerinin keşfi ve son yirmi yılda onlar üzerinde daha fazla odaklanan araştırma, CSC türleri hakkındaki anlayışımızı geliştirdi. Bununla birlikte, ortaya çıkan kanıtlar, CSC’lerin TME’lerinde iyi beslendiğini ve korunduğunu, CSC’leri ortadan kaldırmak için CSC’ye özgü hedefli tedaviyi, birçok farklı kanser tedavisinde zorlu bir görev haline getirdiğini göstermektedir. Bu nedenle, tedaviyi veya diğer yenilikçi yaklaşımları hedefleyen CSC’ye özgü kök hücre belirteçlerinde veya sinyal yollarında iyileştirmeler, ardından titiz deneysel ve klinik çalışmalar, kanser hastalarının yaşam beklentilerini iyileştirmek veya kanserleri iyileştirmek için gelecekteki kanser tedavilerinin geliştirilmesi için hayati önem taşımaktadır.
ANAHTAR KELİMELER
Kanser kök hücreleri (CSC’ler) · Hücre yüzey belirteçleri · İlaç hedefleri · Yumurtalık kanseri
kök hücreler (OCSC’ler) · Tiroid kanseri kök hücreleri (TCSC’ler) · Melanom kanseri kökü
hücreler (MCSC’ler) · Pankreas kanseri kök hücreleri (PCSC’ler) · CSC sinyal yolu ·
Hedgehog(Hh) · Çentik · Kanatsız tip (Wnt)/β-katenin · Dönüşen büyüme
faktör-β (TGF-β) · Nükleer faktör-κB (NF-κB) · İnsülin benzeri büyüme faktörü
1 (IGF1) · Farklılaşma kümesi (CD)
KAYNAK: Cancer Stem Cells: New Horizons in Cancer Therapies, Editörler: Surajit Pathak Antara Banerjee
ÇEVİRİ: Sema Çolakoğlu-Elif Sema Kaya