
10. BÖLÜM : Pediatrik Akut Lenfoblastik Lösemi (ALL)
Peter Bader, Franco Locatelli, ve Christina Peters
Akut lenfoblastik lösemi (ALL), yaklaşık olarak yılda 15 yaşından küçük 100.000 çocukta 3-4 vaka ile çocuklukta ve büyüme çağında en sık karşılaşılan kötü huylu rahatsızlıktır. Çok modlu kemoterapi tedavüldeki ALL tedavilerinin temelini oluşturuyor. Ulusal ve uluslararası işbirliklerine dayalı ileriye dönük ardışık rastgele klinik deneyler, ALL’nin çocukluktaki prognozu gün geçtikçe önemli ölçüde geliştirilmiştir. Günümüzde, %90’a varan pediatrik ALL hastaları hayatta kalacaktır.
Ancak, ALL hastalarının %15-20’sinde en neticede hastalığın tekrardan nüksü söz konusudur. Bu hastaların %60-80’i yoğun kemoterapi sistemleri ile ikinci bir tam hafifleme (CR) elde ederler. İkinci CR elde etmenin yüksek olasılığının aksine, erken kemik iliği nüksüne sahip hastalar (yani teşhisten 30 ay sonra ortaya çıkan nüks) ek tedavi olarak allojenik kök hücre transplantasyonu (allo-SCT) kullanılmışsa da verimsiz bir prognoza sahiplerdir. (Locatelli et al. 2012). Berlin-Frankfurt-Munster Grubu (BFM)’den alınan bilgiye göre, hastalar nüksetmeye, immün fenotipe ve teşhis ile nüks arasındaki zaman aralığına göre gruplara (SI, S2, S3 ve S4) ayrılabilir. S3 ve S4 hastalarında prognoz SI/S2 çocuklara göre tüm hasta gruplarında (von Stackelbert et al. 2011) sadece %25-30 yaşama şansı ile daha kötüdür. Yakın dönemde, remisyonu başarabilmiş ve uyumlu bir donörden nakil alabilmiş hastalarda hayatta kalma oranı %65 ve %69’dur. (Peters et al. 2021).
CR I’deki yüksek riskli hastalar veya düşük risk profiline sahip olup nüksetmiş hastalarda allo-SCT takipli klasik kemoterapi %80’e varan bir başarıyla hastaları iyileştirebilir. (Peters et al. 2015, 2021). Tezat olarak, allo-SCT’den sonra nüksetme görülen hastalarda, uzun vadeli hayatta kalma bu orana yakın değildir, hastaların sadece %15’i hastalığı atlatır (Kuhlen et al. 2018). Şimdiye kadar, uzun vadeli hayatta kalma sadece hastanın ek bir CR elde edebildiği ve ikinci bir nakil almaya yeterince uygun olduğu durumlarda ikinci bir allo-SCT aracılığı ile mümkün olabilir. İkinci allo-SCT dikkate değer bir toksisite ve mortalite oranı taşır ve tedavi yaklaşık olarak 6-8 ay sürer; sonuç olarak bu hastaların %30’u hayatta kalır. (Yaniv et al, 2018).
Böylece, çocuklar ve aşağıdaki durumlara sahip olan büyüme çağındaki gençler arasında karşılaşılmamış tıbbi bir ihtiyaç doğar:
-Birincil refrakter ALL,
-Tedavi refrakteri nükslü ALL,
-İkinci defa nükseden ALL, veya
-Allojenik SCT sonrasında nükseden ve
-Yüksek riskli ALL’ye sahip allo-SCT’ye ihtiyacı olan fakat tıbbi sebeplerden ötürü prosedüre uygun olmayan hastalar.
Sonuç olarak, CD-19-yollu CAR-T hücresi terapilerinin tanıtımıyla, bu hastalar klinik çalışmalar ve nihayetinde lisanslı CAR- T hücresi deneyleri için adaylardır. (Maude et al. 2018). 25 yaşına kadar ulaşabilen bu hasta grubu için, bir CAR-T hücresinin ürünü şu an FDA ve EMA tarafından onaylıdır. Yukarıda belirtilen hasta gruplarına dahil olan çocuklar, ergenler ve genç yetişkinler CAR-T hücre terapilerine tepki verir. Bunların yeni tedavi seçeneklerinden en çok yararlanan uygun adaylar olduğu kanıtlanmıştır. Tasarı halindeki ve birkaçı çoktan araştırmaya başlamış olan muhtemel çalışmalar gösteriyor ki CAR-T hücre tedavisinde en iyi kazanç hastaların hastalığın erken bir safhasında tedavi edildiği zaman elde ediliyor.
Önemli Noktalar
• İkinci nüksteki refraktör rahatsızlığa sahip ya da allo-SCT’den sonra nükseden ALL hastaları CD19 CAR-T hücre terapisinde düşünülebilir.
• Etkili lenf tüketen kemoterapi, CAR-T hücrelerinin yayılmasını sağlamak için gereklidir.
• Ölçülebilir rezidüel hastalığın (MRD) seviyesi yanıt ve uzun ömürlü remisyon ile ilişkilendirilebilir.
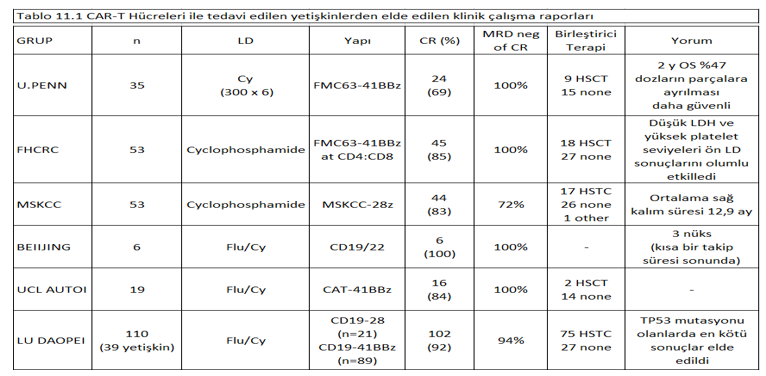
11. BÖLÜM: Yetişkinlerde Akut Lenfoblastik Lösemi
Elad Jacoby, Nicola Gökbuget, ve Arnon Nagler
ALL, lenfoid öncü hücrelerin, bimodal insidansla ve erken çocukluk döneminde ya da yaşlılıkta pik eden kötücül hastalığıdır. Çocuklarda ALL, hastaların %85’ten fazlasının uzun süreli hayatta kalma başarısı ile kusursuz bir prognoza sahip olmaya eğilimlidir. Genç yetişkinlerdeki sonuç da önemli ölçüde iyileşti. Hayatta kalma oranları yaş ile doğru orantılı bir şekilde azalmaya eğilimlidir. (Dores et al. 2012), kısmen farklı genetik arkaplanlara bağlı olarak, Philadelphia-kromozomu-pozitif (Ph+) ALL ve Ph-benzer ve KMT2A yeniden düzenlemesinin yükseltilen payıyla (Iacobucci ve Mullighan 2017). Pediatrik-ilhamlı perhizlerin başlatılması yetişkinlerdeki sonuçları iyileştirdi, ancak bu perhizler daha yaşlı hastalarda daha az hazmedilmiştir (Curran ve Stock 2015).
ALL için uygulanan standart peşin terapi kortikosteroidleri, multiajan kemoterapiyi, antimetabolitik terapiyi ve intratekal terapiyi içerir. İndüksiyonu izleyen, takviye ve bakım terapisi önceliklidir. Yüksek riskli vakalarda, allojenik hematopoetik kök hücre nakli (allo-HSCT) ilk remisyon olarak düşünülür. Nükseden ALL’ye sahip yetişkinlerin kemoterapiyle remisyon elde etmede çok düşük bir şansları vardır (Frey ve Luger 2015). CD22’yi hedefleyen bir antikor ilaç konjugatı olan inotuzumab ozogamicin ve CD19 ve CD3’ü hedefleyen bir bispesifik tutucu olan blinatumomab gibi yeni etmenler remisyon oranlarını arttırmaktadır, ancak hayatta kalma oranı fakir kalmıştır (Kantarjian et al. 2016, 2017). Nüksetme için uygulanan terapi, erken ortaya çıkmadıysa, genelde allo-HSCT aracılığıyla sürdürülür. İki ya da daha fazla terapi denenmiş tedavisi güç ALL vakaları, CAR-T hücre terapisi için düşünülebilir.
Yetişkinlerde ALL İçin CAR-T Hücre Tedavisi
Şu anda, hiçbir kuruluş CAR-T hücre ürünlerini 25 yaşından büyük yetişkin ALL hastaları için onaylamış değildir.
Yaşları 18-25 arasında değişen ve tisagenleciösel için uygun genç erişkinler, ELİANA test çalışmasına dâhil edilmişlerdir. Tek kuruluşla olarak yapılan diğer deneyler de pediatrik odaklı bir çalışmaya dâhil edilmiştir.
Çok az sayıda grup, ALL’li erişkinlerde yapılan klinik çalışmaları bildirmiştir. Çoğu çalışmaya genelde genç erişkinler dâhil edilmiştir ve bu çalışmalar seçilmiş hasta gruplarını temsil etmektedir.
Bu denemelerdeki iyileşme oranları, sitogenetik geçmişine bakılmaksızın kimi zaman yüksektir ve 70’den fazla hastanın tam iyileşme oranı ile önemli parçalara sadece CAR-T tedavisi alan hastaların aksine tüm hastaları temsil eden tedaviye yanıt oranları, tedavi amaçlı olarak bildirilmiştir.
Toksisite, tüm çalışmalarda bir sorun olmaktadır ve dozların parçalara bölünerek, sıfırıncı günde kısmi bir dozun verilmesinin ve geri kalanının da birkaç gün içinde verilmesinin daha güvenli olduğunu göstermiştir.
Aynı zamanda, hastalık yükünün fazla olduğu hastalara, toksisiteyi engellemek için daha düşük dozlar uygulanmıştır.
Güvenliği arttırmak için, izlenen alternatif yaklaşımlar, dozların uygulanmasından önce tocilizumab’ın ve düşük dozda olmak üzere steroidlerin verilmesini içermektedir.
CD19’lu düşük affiniteli yeni bir CAR-T hücresinin kullanılması, daha düşük toksisite ile ilişkilendirilmiştir.
ALL’li erişkin hastalarda, daha yüksek iyileşme oranları ve daha iyi sonuçlarla ilişkilendirilen öngörücü faktörler, kemik iliğindeki blast miktarıyla ölçülen düşük hastalık yükünü, daha düşük LDH düzeyini ve lenfosit azalmasından önceki yüksek trombosit sayısını içermektedir.
Nüksün belirlenmesi ile CAR-T hücrelerinin verilmesi arasındaki gecikme süresinden dolayı, çoğu vakada, geçiş tedavisinin uygulanması gereklidir. Uygun tedavi rejimlerinin belirlenmesi gerekmektedir.
CAR-T’ler, verilmeden önceki ve uygulanabilecek olası geçiş tedavilerinden sonraki lösemik yükün belirlenmesi önerilmektedir. Çünkü yüksek hastalık yükünün görüldüğü hasta gruplarındaki sonuçlar, inatçı hastalığın olmadığı ve minimal kalıntı hastalığın olmadığı gruplara göre daha zayıftır.
Her ne kadar bu durum, daha dirençli hastalardan oluşan bir grubu içerse de daha önce blinatumomab ile tedavi edilmiş olan ALL’li hastalarda, sonuçlar daha zayıf olabilmektedir.
TP53 mutasyonları, daha kötü sonuçlar ile ilişkilendirilmiştir. Ek olarak; erişkinlerde, çocuklarda da benzer bir durum olmak üzere, fludarabin ile siklofosfamidin beraber kullanıldığı tedavilerde, sadece siklofosfamidin tek başına kullanıldığı tedavilere göre, daha iyi sonuçlar elde edilmiştir.
MKH (minimal kalıntı hastalık) durumunun CAR-T tedavisinden sonra akım sitometrisi ile belirlendiği birçok çalışma, akım sitometrisine göre iyileşmenin görüldüğü, neredeyse tüm durumlarda MKH’nın negatif olduğunun göstermiştir.
MKH’nin, PCR ya da yeni nesil dizileme (YND) ile belirlenmesi daha hassastır ve CAR-T hücrelerinin uygulanmasından sonra YND ile MKH’nın negatif olduğunun gösterildiği durumların, iyileştirilmiş uzun dönem sonuçlar ile ilişkilendirildiği gösterilmiştir.
Her ne kadar dayanıklı CAR-T hücrelerinin verilmesi, çocuklarda nükseden ALL’nin kesin tedavisi olsa da, erişkinlerden elde edilen veriler tartışmalıdır.
Dayanıklılığı kısa vadeli olan CD-28 temelli CAR-T hücreleri ile tedavi edilen hastalarda, ALL-HKHT ile sonuçlarda iyileşme gözlenmemiştir. Buna karşın, CAR-T tedavisinden sonra, tam iyileşme esnasında CLT-019 ile tedavi edilen erişkin hastalarda, daha iyi sonuçlar elde edilmiştir.
Bazı merkezler, minimal kalıntı hastalığının (MKH) negatif olduğu hastalarda bile, CAR-T tedavisine müteakip olarak ALL-HKHT’yi önermektedirler.
CAR-T tedavisini takiben; moleküler yöntemler ile MKH’nın pozitif olduğu hastalar, CAR-T hücrelerinin verilmesinden sonra bu hücrelerin çabuk kaybedildiği hastalar ve daha önceden HKHT almamış hastalar, bütünleştirici HKHT tedavisi için adaydırlar.
CAR-T TEDAVİSİNDEN SONRA NÜKS GÖRÜLMESİ
Hastaların %30-%50’sinde, CAR-T tedavisinden sonra nüks meydana gelir. CAR-T hücrelerinin dayanıklı olduğu örneklerde, vakaların %40’ına kadar olmak üzere, nükseden ALL’de CD-19 ifadesinin olmama ihtimali daha yüksektir.
İkinci doz CAR-T hücreleri, CAR-T hücre tedavisinden sonra nükseden ALL’li hastalarda ya da bu tedaviye yanıtsız kalmış hastalarda, nadir yanıtlara yol açmıştır. Diğer tedaviler, örneğin yeni ve antikor temelli ya da diğer antijenleri hedef alan CAR-T hücreleri, seçenekler arasında yer almaktadır.
Önemli Noktalar
12. BÖLÜM: Diffüz Büyük B Hücreli Lenfoma ve Birincil Mediastinal Lenfoma
Bertram Glass ve Marie Jose Kersten
Büyük B hücreli lenfoması olan ve herhangi bir zamanda klasik immünkemoterapiye cevap vermeyen ve kemoterapiden sonraki 1 yıl içinde nükseden hastalarda, sonuçlar zayıftır.
Scholar - One çalışması, bu hastalar için uzun dönemde sorunsuz sağ kalımın %20’den az olduğunu göstermiştir.
Kimerik antijen reseptörlü T hücre tedavisi, bu hastalara uygulamak için azımsanamayacak bir gelişmedir ve bu tedavi uzun dönemli bir iyileşmeyi ve hastaların %30 ile %40’ı için tedavi edici olasılığı vardır.
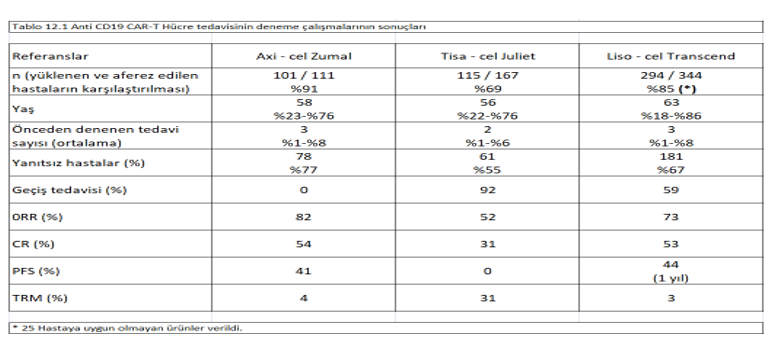
Şuana kadar Avrupa’da iki ürün, (axicabtagene ciloleucel ve tisagenlecloucel) Avrupa Tıbbî Birliği tarafından onaylanmıştır. Üçüncü bir ürün ise (lisocabtagene maraleucel) 2022 yılında piyasaya sürülecektir. Tüm bu ürünler, önceden en az iki sistemik terapiye yanıt vermeyen hastalarda kullanım için onaylıdır. Bu da her ne kadar çok geniş kapsamlı da olsa, CAR-T uygulamasının gerekli olduğu olası durumları tanımlamaktadır.
Müteakip çalışmalar, bir sonraki tedavi prosedürü olarak CAR-T hücrelerinin uygulanabileceği hasta topluluğunu daha iyi tanımlamakta yardımcı olabilir. Yakınlarda, kök hücre nakline uygun olan hastalarda rastgele olarak yapılan ve CD-19 CAR-T’yi, CARE standartları ile karşılaştıran Faz-3 çalışmalarının sonuçları bildirilmiştir.
Tisa-Cel’in kullanıldığı BELINDA çalışmasında, sonuç noktasına (önceden belirlenen ve verilen tedavilerin işe yarayıp yaramadığının değerlendirileceği noktaya) ulaşılamamıştır.
Bu çalışmalardan ikisi olan, Axi-cel yapısının kullanıldığı ZUMA-7 ve Lisa-cel’in kullanıldığı TRANSFORM çalışması, hem primer (EFS) hem de sekonder varış noktalarına (EFS & ORR) ulaşmıştır. İki çalışmada da, 0,72 ve 0,51 risk oranları (tedavi edilenlerde meydana gelen olumsuz etkilerin, kontrol grubunda meydana gelen olumsuz etkilere oranını temsil eder) oranları ile, OS ile ilgili olarak olumlu bir sonuç yönünde güçlü bir sayısal eğilim gözlemlenmiştir.
TRANSFORM çalışmasının kısa bir ortalama gözlem süresi (tanının konduğu ya da bir hastalık için verilen tedaviye başlandığı tarihten, teşhis edilen hastaların yarısının halen hayatta olduğu tarihe kadar geçen zaman) bulunmaktadır. Bu yüzden, OS ile ilişkili sonuçlar tam olarak belirlenememiştir.
İki çalışmada da CAR-T tedavisinde, ASCT’ye (otolog kök hücre tedavisi) kıyasla yaşam kalitesinde kaydadeğer bir iyileşme görülmüştür. Bu iki bileşikle (Axi-cel ve Lisa-cel) birlikte olmak üzere AntiCD-19 CAR-T tedavisi, kök hücre nakline uygun olan R/R büyük B hücreli lenfomalı hastalarda, uygulanan ilk tedavinin başarısız olması ya da kaldırılamayacak yan etkilerinin olması durumunda, ikincil bir tedavi seçeneği olarak değerlendirilmelidir.
Ele alınacak hasta kitlesi: Lenfomaya özgü bir açıdan bakmak
Tedavi Tarihçesi
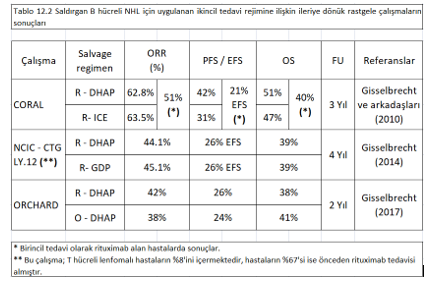
Klinik risk faktörlerine bağlı olmak üzere, büyük B hücreli lenfoma hastalarının %5 ila % 50’si ilk tedaviye yanıt vermeyebilir. Genel olarak bakıldığında, hastaların %30 ila %40’ı, bir kurtarma tedavisine (diğer tedavilere yanıt alınamadığında uygulanan) ihtiyaç duyacaktır. Yüksek doz kemoterapi için uygun hastalar şu anda platinum içeren bir kurtarma tedavisi ve bunu takiben yüksek doz kemoterapi ile otolog kök hücre nakli olacaklardır. Özetle, iyileşme oranları %35 ila %50 arasında değişkenlik göstermektedir ve otolog KHT’den sonra da %50 oranında bir tedavi başarısızlığı riski vardır. Uzun vadeli, olaysız genel sağ kalım oranı %25 civarındadır.Bu yüzden nüks eden ya da tedaviye yanıtsız, agresif B hücreli lenfoması olan ve yaşça daha genç hastaların yaklaşık %75’i CAR-T hücre tedavisine teorik olarak uygundurlar. Kurtarma tedavisi olarak yapılan ikinci tedavi denemesinden sonra da iyileşme görülmeyen hastalar, CAR-T hücre tedavisi açısından değerlendirilmelidirler.
Nüks eden ya da tedaviye yanıtsız olan ve yaşı daha ileri hastalarda, ikinci tedavi denemesinde pek iyi sonuçlar elde edilememiştir. Geniş ve rastgele bir Faz-1 deneme çalışması, primer yanıtsız hastalığı olan hastaların asla uzun vadeli bir iyileşme göstermediklerini ve genel ortalama sağ kalım süresinin, 6 aydan kısa olduğunu göstermiştir. Hastaların %20 ila %30’unda, R-gemsitabin - oxaliplatin gibi platinyum ya da bendamustin içeren bileşikler ile iyileşmenin uyarılması mümkündür. Ancak, birleştirici bir tedavinin olmamasından dolayı, uzun vadeli sonuçlar tüm serilerde zayıftır.Tedavi yöntemlerinin etkililiği ve güvenliğiyle ilgili istatiksel kanıtlar elde etmek için yapılan çalışmalardan olan 3 tane faz 3 çalışmasında, hastaların %23 ila %42’si, 65 yaş ve üzerindeydi ve şu anda iyileşme oranı açısından CAR-T hücrelerinin etkiliği ile ilgili bir gösterge yoktur; hastalık ilerlemeksizin sağ kalım oranı ise daha yaşlı hastalarda daha düşük bulunmuştur. Bir klinik çalışmadan bağımsız olarak genel sağlık kayıtlarından ve günlük hayatta karşılaşılan hastalardan elde edilen klinik gözlemlere göre; yaşlı hastaların yüzdesinin daha yüksekti ve özellikle norotoksisiste olmak üzere artmış toksisite ile ilgili bazı kanıtlar vardı. Ancak, tedavinin etkililiği de bir o kadar yüksekti.
Bu yüzden önceden uygulanan iki sistemik tedaviye de yanıtsız kalıp nüks eden ya da saldırgan B hücreli lenfomalı ve kök hücre nakline elverişli olmayan hastalarda CAR-T hücre tedavisi seçeneği ele alınmalıdır.
CAR-T hücre infüzyonundan önce remisyon durumu ve tümör hacmi
CAR-T hücreleri, yanıtsız ve erken dönemde nüks eden hastalık için değerlendirmeye alınmıştır. Üç adet onaylı CAR-T ürününün üzerinde yapılan ve tedavi yönteminin güvenliğinin ve etkililiğinin gösterilmesi ve onaylanması için yapılan Faz 3 çalışmalarında, yanıtsız kalan hastaların yüzdesi %52 ila %79 arasında değişmektedir.Uygulanan son kemoterapiye yanıtsız olmak bu çalışmada önemli bir öngörücü faktör değildi. Bu yüzden, otolog ya da allojenik kök hücre naklinin (SCT) aksine, iyileşme döneminde olmak, CAR-T hücre uygulaması için bir ön koşul değildir.Ancak, etkinliğin ve güvenliliğin incelendiği bu Faz 3 deneme çalışmaları ve hastaların sağlık durumuna ilişkin sağlık kayıtlarından elde edilen veriler, yüksek tümör hacmini, lenfosit tüketen tedavilerden önceki toplam kitle çapının ya da basitçe yükselmiş LDH seviyelerinin de yansıttığı üzere, devam etmekte olan tam yanıt ya da PFS açısından 3.0 risk oranıyla, olumsuz bir öngörücü faktör olarak tanımlamaktadır.Ek olarak, hızlı ilerleyen hastalığı olan hastalar genelde geçiş tedavileri denemelerine yanıt vermemektedirler ve sistemik geçiş tedavisine ihtiyaç duyulması, tedaviye yanıt ve sağ kalım için olumsuz bir öngörücü etkendir.
CAR-T hücre tedavisinin bir hasta açısından değerini ele aldığımızda, CAR-T hücrelerinin hastaya uygulamadan önceki hastalık kontrolü de bir etken olarak göz önünde bulundurulmalıdır. Ancak, bu etkenin aynı zamanda herhangi bir tedavi seçeneğinin sonuçları üzerinde de etkisi bulunmakta olup CAR-T hücre tedavisinin uzun vadeli iyileşme sağlamadığı ve bu yüzden hastaya verilmesinin tercih edilmeyeceği nokta, halen tartışma konusudur.
Histoloji
Sırayla %76, %80 ve %64 olmak üzere ZUMA-1, JULIET ve TRANSCEND çalışmalarındaki hastaların çoğunda, DLBCL vardı ve vakaların %16 - %22’sinde de dönüşüme uğramış FL (folliküler lenfoma) bulunmaktaydı ve PMBCL’li hastaların sadece küçük bir kısmı çalışmalara dahil edilmiştir. (Bu oran ZUMA-1’de %8, TRANSCEND’de ise %6’ydı.) DH/TH lenfomalarıyla ilgili verilere her hastada ulaşılamadı. Belirli alt gruplarda, yanıt oranı ya da PFS açısından kaydadeğer bir fark yoktu.
GÖZ ÖNÜNE ALINMASI GEREKEN HASTA TOPLULUĞU: HASTAYA ÖZGÜ BAKIŞ AÇILARI
CAR-T hücre tedavisi, en önemlisi de sitokin salınımı sendromu ve immun-yanıt hücreleriyle ilişkilendirilen sinirsel toksisite olmak üzere, alışılmadık ve bazen ağır toksisitere yol açabilir. Bu toksisiteler, genelde hücre verildikten sonraki 2’nci gün ile 10’ncu gün arasında meydana gelir ve birkaç günden, birkaç haftaya kadar devam edebilir. Tedaviye bağlı mortalite nadiren görülür ve çoğu durumda, bu toksisite geri dönüşlüdür. Diğer önemli yan etkiler, birkaç haftadan birkaç aya kadar devam eden ağır nötropeniyi, uzun vadeli olarak B-hücrelerinin azalmasını ve hedef alınan antijenin normal dokularda da bulunmasına bağlı olarak meydana gelen bir toksisite olan hipogamaglobülinemiyi içermektedir.Bu durumlarda, uygulanan diğer tedavi yöntemleri ile örneğin allojenik kök hücre nakli ile karşılaştırıldığında, CAR-T hücreleri ile ilişkili toksisitenin, genel sonuç üzerindeki etkisi hafiftir.CAR-T tedavisinin toksisite açısından olumlu sonuçları, ilaç test çalışmalarına dahil edilen uygun hastaları seçerken sıkı kriterlerin kullanılmasına bağlanmıştır. Ancak, CAR-T tedavisine ilişkin sağlık sistemlerindeki hasta kayıtlarından elde edilen verilerin güncel analizleri, CAR-T hücre tedavisinin etkinliği ve toksisitenin daha yaşlı ve ek hastalığı bulunan hastalarda bile benzer düzeyde olduğunu göstermiştir.CAR-T hücre tedavisinden sonra, TRM için risk faktörleri iyi tanımlanmamıştır ve diğer tedavi seçeneklerinden elde edilen sonuçları CAR-T hücre tedavisine aktarmak da zor olabilir.En iyi tahmin, yüksek doz kemoterapi için eşlik eden hastalık indeksi ve bunun otolog kök hücre nakli yapılmış hastalardan elde edilen sonuçları kullanılarak yapılabilir. Buna benzer bir incelemede, 1 yıl sonra HDT ilişkili NRM değeri %3.3 ile %7 arasında değişmekteydi ve bu da CAR-T hücre tedavisinden elde edilen gözlemler ile (tedaviyle ilişkili mortalite < %5 olmak üzere) uyumluydu.
DİĞER TEDAVİ SEÇENEKLERİ
Geçmişte, allojenik kök hücre nakli, ilave kurtarma tedavilerinden sonra, kemoterapiye yanıtsız hastalarda kullanılan tek seçenekti.Yakın geçmişte, antikor-ilaç bileşikleri ve iki antijene özgü antikorlar, burada tartışılan hasta topluluğunda ilginç sonuçlar göstermişlerdir. Bu gruptaki ilk ilaç olan polatuzumab vedotin, Avrupa ve ABD’de onay almıştır. Birçok yeni ilaç, yakın gelecekte piyasaya çıkacaktır ve CAR-T hücre tedavisini bu yeni tedavi seçenekleriyle birleştirmek gelecek için büyük bir görev olacaktır.
ALLOJENİK KÖK HÜCRE NAKLİ
Geçmişte, allo-KHN (SCT) çoğunlukla otolog kök hücre naklinden sonra nüks görülen hastalarda kullanılmıştı ve veriler uluslararası kayıtlardan bildirilmişti. Yüksek riskli saldırgan lenfomalı hastalarda yapılan ileriye dönük bir çalışma 4 yıl sonra, sırasıyla PFS’yi %40 ve OS’yi %3.9 olarak göstermiştir.Çalışmaların sonuçları ve kaydedilen veriler karşılaştırılırken, oluşabilecek olası yanlılıklar hesaba katıldığında yapılan allojenik kök hücre nakillerinin bir çoğunda, hastalık ilerlemeksizin sağ kalım açısından bakıldığında, CAR-T tedavisine benzer oranda olabilir. Fakat, lenfomaya karşıtlılık ve toksisite arasındaki denge, CAR-T tedavisinde olduğundan önemli ölçüde farklıdır. Allojenik kök hücre naklini takiben bu tedavinin mortalite ve morbidite oranı, her yaş grubunda belirgin bir şekilde daha yüksektir. Bu yüzden, allojenik kök hücre nakline uygun hastalarda bile, CAR-T hücreleri öncelikli olarak tercih edilmelidir. Allojenik kök hücre nakli, eğer hasta ek kurtarma tedavilerine yanıt veriyorsa, CAR-T hücre tedavisinin başarısız olduğu hastalarda halen bir tedavi modeli olarak seçenekler arasında yer almaktadır.
ANTİKOR – İLAÇ BİLEŞİKLERİ
Polatuzumab vedotin, önceden uygulanan en az bir tedaviye yanıt alınamayan ve kök hücre naklinin uygun olmadığı hastalarda kullanılması için onaylanan ilk antikor-ilaç bileşiğidir. Rastgele olarak yapılan ve ilacın güvenliliğini ve etkinliğini test eden bir faz 2 çalışmasında ve çalışmaya başladıktan sonra başka hastaların da dahil edildiği kohort çalışmasından, tedavi edilen hasta topluluğu, çoğu CAR-T hücre çalışmasındakiyle benzerdi. Yanıtların bazıları, tedavinin bitiminden sonra da devam ediyor gibi görünmektedir. Sınırlı sayıda hastayla ve sınırlı bir gözlem süresiyle, hastaların yaklaşık %15-20’sinin süreğen bir iyileşme durumunda olabileceği tahmin edilmektedir. Bu yüzden, eğer var ise tedavi edici bir yöntem olarak gücü zayıftır ve daha uzun bir süreyle izlem yapılması ve ileriye yönelik klinik çalışmalarda da onaylanması gerekmektedir. Antikor-ilaç bileşikleri, örneğin polatuzumab vedotin, CAR-T hücrelerinin uygulanmasından önce hastalığın kontrolünü sağlamak için geçiş yaklaşımı da denilen bir yolda kullanılabilir. Polatuzumab’ın T hücrelerine olağanüstü düzeyde toksik olan bendamustin ile birlikte kullanılması onaylanmıştır.CAR-T hücrelerinin üretimi için otolog T hücreleri aferez edilmeden önce bendamustin uygulamasından kaçınılmalıdır.
BİSPESİFİK (İki antijene aynı anda bağlanabilen antikorlar)
Bir takım bispesifik T hücrelerine bağlanan ve CD20 antijenini lenfomaya özel bir hedef olarak ve CD3’ü T hücresinin bağlanma bölgesi olarak kullanan antikorlar, oldukça umut verici sonuçlarla bildirilmiştir.Yanıt oranları, bazı ajanlar için yüksektir ve toksisite de epeyce sınırlıdır. Ne var ki, gözlemlendikleri süre kısıtlıdır ve PFS ile ilgili verilere de henüz ulaşılamamıştır. CR’ye (tam iyileşme) ulaşan hastaların DOR’unun (tümörün yayılmadan veya büyümeden tedaviye yanıt vermeye devam ettiği sürenin uzunluğu) şimdiye kadar oldukça iyi olduğu ve CAR-T hücrelerinde gözlemlenen değerle aynı aralıkta olduğuna ilişkin göstergeler mevcuttur. Rutin uygulamada kullanıma sunulduğunda, CAR-T hücrelerine kıyasla tedavi için farklı endikasyonları önemli bir klinik zorluk haline gelecektir ve tercihen bire bir klinik deneylerde araştırılmalıdır.
Önemli Noktalar
• Dönüştürülmüş FL ve PMBCL dahil olmak üzere LBCL'li hastalar, ≥ 2 sıra sistemik tedaviden sonra relaps/refrakter hastalık vakalarında CD19 CAR-T hücre tedavisi için düşünülmelidir.
• Üst yaş sınırı yoktur, ancak hastaların uygunluk, kardiyak fonksiyon ve diğer organ fonksiyonları açısından uygunluk kriterlerini yerine getirmesi gerekir.
• LDH'si yüksek ve hızla ilerleyen hastalığı olan hastaların fayda görme olasılığı daha düşüktür.
13. BÖLÜM: Manto Hücreli Lenfoma
Noel Milpied ve Martin Dreyling
Manto hücreli lenfoma, çok çeşitli klinik seyir gösteren farklı bir lenfoma alt tipidir. Yerleşik yüksek riskli biyolojik faktörler arasında blastoid sitomorfoloji, yüksek hücre proliferasyonu (Ki-67 > %67) ve p53 mutasyonları bulunur (Aukema ve ark. 2018). Mevcut birinci basamak yaklaşımlar hala kemoterapiye dayalı olsa da, özellikle erken nüks vakalarında BTK inhibitörleri tercih edilen hedefli yaklaşımdır (POD24) (Dreyling ve diğerleri 2017; Visco ve diğerleri 2021). Bununla birlikte, BTK inhibitörleri altında nüks/ilerleme vakaları, geleneksel rejimlerden sonra kasvetli bir sonuçla son derece agresif özellikler gösterir (Martin ve ark. 2016)
CAR-T Hücreleri İçin Klinik Endikasyonlar
Aralık 2020'de EMA tarafından verilen koşullu pazarlama izninin ardından Tecartus (Gilead), Avrupa'da mantle hücreli lenfoma hastalarına uygulanabilen ilk otolog anti-CD-19 CAR-T hücre tedavisidir. Buna karşı dirençli lenfoma veya tedavi nüksetmesi kabul edilen hastalar, Bruton tirozin kinaz (BTK) inhibitörünün a hücresini içeren doğrulanmış manto histolojik olarak tedavi edilen bu iki veya daha fazla çizgiden sonradır. Bu kayıt, yakın zamanda bildirilen çok merkezli bir faz 2 çalışmasının sonuçlarına dayanmaktadır (Wang ve ark. 2020a). Kısaca, medyan yaşı 65 (38-79) olan 74 hasta kaydedildi ve %88'i herhangi bir zaman noktasında BTK inhibitörü tedavisine refrakterdi veya nüks etti. CAR-T hücre ürünü 71 ve 68 için üretilebilir.
|
Tablo 13.1 Güncellenmiş yanıt oranları (Wang ve ark. 2020b) |
||||||
|
|
ORR(%) |
CR(%) |
PFS (%) |
OS (%) |
||
|
12 m |
15 m |
12 m |
15 m |
|||
|
Tx Niyeti (74 hasta) |
85 |
59 |
|
|
|
|
|
Prim analizi (60 hasta) |
93 |
67 |
61 |
59 |
83 |
76 |
5. Günden 3. Güne kadar fludarabin (30 mg/m²/gün) ve siklofosfamidden (500 mg/m²/gün) oluşan bir şartlandırma rejiminden sonra 0. Günde 2 x 106 CAR-T hücresi/kg aldı. 74 hastanın tümünün (tedavi amaçlı popülasyon) genel yanıt oranı, %59'luk bir CR oranı ile %85 idi. Daha da önemlisi, 15 ay sonra, değerlendirilebilir 60 hastanın %59'u hala remisyondaydı (Wang ve ark. 2020b) (Tablo 13.I).
İlginç bir şekilde, yanıtta karşıtlık hedefi, stratejiler arasında tutarlı konvansiyonel, anahtar alt gruplar, yüksek riskli özelliklere sahip hastaları içeren hastaların yüzdeleriydi (Wang ve ark. 2020a).
Olumsuz olaylar başlıca sitopeniler (> derece 3: %94) ve enfeksiyonlardır (> derece 3: %32). Hastaların toplam %26'sında, KTE-X19 uygulamasından 90 gün sonra nötropeni (hastaların %16'sında), trombositopeni (%1 6) ve anemi (%12) dahil olmak üzere 3. derece veya daha yüksek sitopeni vardı.
Bu cesaret verici sonuçlar, başka bir CAR-T hücre yapısı için de doğrulanmıştır (Lisocabtagene Maraleucel; Palomba ve ark. 2020). Kritik Değerlendirme Bu seçilmiş mükemmel hastalardı.
Kritik değerlendirme
Bu mükemmel sonuçlar, yüksek oranda seçilmiş hastalarda prospektif bir çalışma bağlamında elde edilmiştir. Son zamanlarda benzer sonuçlar bir "gerçek hayat ortamında" rapor edilmiştir. (Wang ve ark. 2021)
Onaylanmış endikasyonun mevcut algoritmasında, bu tedavinin uygulanmasından önce birkaç başka koşul yerine getirilmelidir: hastanın dikkatli bir şekilde incelenmesi, deneyimli bir iç disiplinli ekip ve takip kaynakları olan özel bir hastane.
Gelecekteki denemelerde, bu zorlu tedavinin fayda-risk oranı, daha önceki tedavi hatlarında yeniden tartışılacaktır.
Önemli Noktalar
• BTK inhibitörü ibrutinib altında ilerleyen nüks MCL'li hastalar, CD 19 CAR-T hücre tedavisi için düşünülmelidir.
• CAR-T hücrelerinin genişlemesine izin vermek için etkili lenfo-tüketici kemoterapi gereklidir.
14.BÖLÜM: Kronik Lenfositik Lösemi
Olivier Tournilhac ve Peter Dreger
KLL için CAR-T Hücrelerinin Klinik Gelişimi
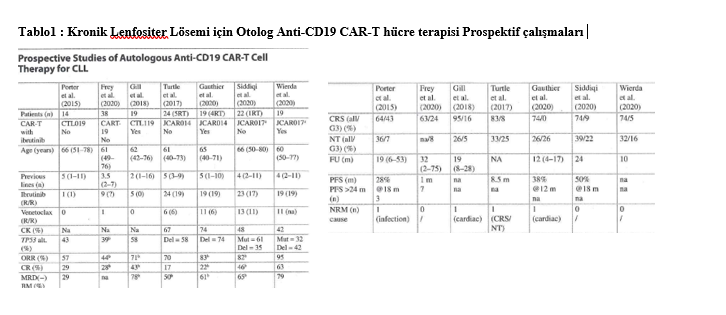
Kronik lenfositik lösemi (KLL), CAR-T hücrelerinin değerlendirildiği ilk iki antiteden biri olmasına rağmen, henüz klinik rutine girmemiştir. Porter ve diğerleri tarafından yapılan dönüm noktası çalışmasından bu yana. (2011), toplamda 155'ten fazla hastayı içermeyen sadece altı KLL'ye özgü klinik çalışma yayınlanmıştır. (Porter ve diğ. 2015; Gill ve diğ. 2018; Turtle ve diğ. 2017; Gauthier ve diğ. 2020; Siddiqi ve diğ. 2020; Wierda ve diğ. 2020; Frey ve diğ. 2020). Bu çalışmaların altısı, çoğunlukla BTki +/- venetoklaks tedavisi başarısız olan, ağır ön tedavi görmüş hastalarda CD19'a yönelik CAR-T yapılarını araştırdı. Hastaların büyük bir kısmında MRD klirensi dahil olmak üzere %60-95'lik genel yanıt oranlarına rağmen, CR oranları nispeten düşük görünmektedir ve hastalarda CR'ye ulaşan yalnızca birkaç kalıcı yanıt bildirilmiştir. (Porter ve diğerleri 2015; Frey ve diğerleri 2020; Cappell ve diğerleri 2020).
Toksisite %5-20 derece 3 sitokin salınım sendromunu ve %5-25 derece 3 nörotoksisiteyi içerir ve yönetilebilir görünse de, uzun vadeli etkinlik çözülmemiş bir sorun olarak kalır.
CD19 CAR-T hücreleri için CLL'ye özgü etkinlik engelleri, önceden kapsamlı bir şekilde tedavi edilmiş yaşlı KLL hastalarında (Lemal ve Tournilhac 2019), bozulmuş T hücresi motilitesi, bozulmuş T hücresi mitokondriyal uygunluğu ve T hücresi ile birlikte sürekli T hücresi genişlemesi için azaltılmış bir kapasite içerebilir. tükenme (Bair ve Porter 2019).
İbrutinibin eş zamanlı kullanımı, CAR-T hücre genişlemesini bozmadan KRS oranını ve şiddetini azaltabilir (Gauthier ve ark. 2020; Gill ve ark. 2018; Wierda ve ark. 2020)
KRONİK LENFOSİTİK LÖSEMİ (CLL) TEDAVİSİNDE CAR-T HÜCRE TEDAVİSİ İÇİN GÜNÜMÜZ ENDİKASYONLARI
Yeterli örneklem büyüklüğü ve takip bilgilerinin bulunmadığı ve halihazırda kullanıma uygun CAR-T hücresi bulunmadığında, klinik denemeler haricinde, şu an için CLL tedavisinde CAR-T hücre uygulaması için bir endikasyon yoktur. Fakat uygun bir deneme hazırsa, CAR-T hücreleri, CLL yüksek risk 2 grubuna(transplant için yüksek risk grubu EBMT-ERIC önerilerine göre, Dreger et al 2018) alternatif tedavi seçeneği olarak önerilebilir. Transplant için düşük risk grubunda bulunanlara ise allojenik hematopoetik kök hücre transplantasyonu(alloHCT) yaklaşımı uzun dönemli hastalık kontrolü açısından hala daha umut vaat eden bir tedavi yaklaşımıdır.(Tournilhac et al 2020;Roeker et al 2020; Mato et al 2020). CLL için daha etkili CAR-T hücreli tedavilerin gelişi beklenmektedir ve bu algoritmayı hızlıca değiştirebileceği düşünülmektedir.
• CLL için CAR-T hücre uygulamasında günümüzde herhangi bir standart endikasyon yoktur.
• CAR-T hücreleri klinik denemelerde yüksek risk hastalar için alloHCT için bir alternatif olabilir.
Tablo1 : Kronik Lenfositer Lösemi için Otolog Anti-CD19 CAR-T hücre terapisi Prospektif çalışmaları
Önemli Noktalar
• CLL için otolog CAR-T hücreleri yaklaşık 10 yıldır geliştirilme aşamasındadır. BTKi ve BCL2i’nin ikisine de cevapsız hastalarda dahil olmak üzere bu yaklaşımın kötü risk gruplarında ilgi çekici sonuçları vardır.
• Fakat CAR-T hücreleri klinik pratikte uygular hale gelmek için klinik denemeleri ve daha uzun takip sürelerini içeren daha çok veriye ihtiyaç vardır.
15. BÖLÜM: INDOLENT (YAVAŞ SEYİRLİ) LENFOMALAR
Franck Morschhauser ve Pier Luigi Zinzani
Foliküler ve margianl bölge lenfomalarını da içeren Indolent non-Hodgkin lenfoma(iNHL), şimdilerde immünokemoterapi ile birlikte hastalık kontrolü ile ortalama yaşam süresi birçok seride 15 yılın üzerindedir(Kahl ve Yang 2016). Ama iNHL yine de çoğu hastada hala tedavisi mümkün değil olarak düşünülmektedir ve hastalık seyri her bir remisyon periyodu öncekinden daha kısa olacak şekilde relaps ve remisyonlar şeklinde devam etmektedir ve toplam yaşam beklentisi her konvansiyonel terapi ile birlikte azalmaktadır(Batlevi et al 2020). İhtiyaçları karşılanamayan hastalar; başalngıç immünokemoterapisinden sonra 24 ayda hastalık progresyonu gösteren foliküler lenfomanın yaklaşık yüzde 20sinin de dahil olduğu( 5yıllık sağkalım %48(Casulo et al.2015)- ama yine de bu kötü sonucun yanlış tanılı transform olmuş foliküler lenfoma tarafından kaynaklandığı belirsizdir.(Freeman etal.2019); birçok tedavi rejiminde başarısız(5 yıllık sağkalım %23)(Rivs-Delgado et al.2019) bu hastaların iki yanıtsız hastalığı vardır(Gopal et al 2017) ya da otolog kök hücre nakli(ASCT) sonrası relaps olmuştur.(Sesques et al.2020). Fakat anti-CD20 Moab ve lealidomide’in immunomodulatuar bir rejim ile kombine edildiği durumda umut verici sonuçlar vardır(Leonard et al 2019;Morschhauser et al.2019), en yeni onaylanmış terapiler artmış hastalık direncini alt edemez, ve birçok eş zamanlı farklı tedavi yoluyla hastada artmış kümülatif toksisite ile yaşam süresini etkiler. Otolog anti-CD19 kimerik antijen reseptör T hücresi(CAR-T) tedavileri tisa-cel ve axi-cel şimdilerde relaps ve yanıtsız büyük hücreli B lenfomada(LBCL) kullanımı onaylanmış olup, iNHL için de test edilip umut verici sonuçlar görülmüştür.
En az iki farklı terapi sonrasında relaps ya da yanıtsız 146 iNHL hastası(foliküler lenfoma:124, marjinal bölge lenfoması:22) axi-cel’in güvenilirliği ve etkisi için ZUMA-5 faz2 çalışmaları kapsamında değerlendirildi(Jacobson et al.2020) Bunlar arasından 104 hasta etki değerlendirmesi açısından uygundu.( foliküler lenfoma:84, marjinal bölge lenfoması:20). Toplam yanıt oranı %92 ve tam remisyona giren hasta oranı %76 idi. Foliküler lenfoma hastalarında yanıt oranı %94 ve tam remisyon oranı %80 idi. Tedavi yanıtları yüksek risk gruplarında da benzerdi. 17.5 aylık takip süresi boyunca foliküler lenfoma hastalarının %64’ü yanıt vermeye devam etti. Ortalama yanıt süresi, ve sağkalım verilerine ise ulaşılamadı(Gopal etal.2017).Foliküler lenfomalı hastaların güvenilirlik profili daha önceki LCBL gruba göre daha iyi olarak gözlemlendi.(Neelapu et al 2017; Locke et al 2019). 3.seviye ve daha yüksek yan etkiler 126 hastada görüldü(%86), genellikle nötropeni ve enfeksiyon olmak üzere. Yüksek düzey sitokin salınım sendromu folikler lenfoma(FL) kohortunda %6 olarak gözlemlendi. Sitokin salınım sendromunu başlangıcı LCBL’de göülene göre FL’de daha geçti.Bu durum sadece bir hastada sürmeye devam etti ve sonrasında çoklu organ hasarı sonucu öldü(Jacobson et al 2020.) Hastaların %56 sı herhangi bir derecede nörolojik semptomlar yaşadı.(%15’i 3.dereceden büyük semptomlar yaşadı). Çoğu nörolojik semptomlar veri toplama süreci bittiğinde geçmişti(67/70) (Jacobson et al. 2020)
Aynı güvenilir sonuçlar tisa-cel ile de gözlemlendi. Faz 2 ELARA çalışmasında ikinci ya da daha sonraki tedavilerinden 6 ay sonra ya da ASCT sonrası relapslı veya tedaviye yanıtsız 98 yetişkin FL hastası çalışmaya katıldı(Fowler et el 2020). 97 hasta tisa-cel aldı fakat 52’si etki için değerlendirmeye uygundu. ZUMA-5’in aksine, köprü tedaviye izin verildi ve hastaların %43’ü bunu kullandı. Hastaların %65,4’i tam remisyonu sağladı ve toplam yanıt oranı ise yüzde 82,7 idi. 10 aylık ortalama takip sürecinde hastaların %69’u yanıt vermeye devam etti. Medyan yanıt süresi, sağkalım verilerine ise ulaşılamadı. Güvenilirlik için uygun olan 97 hastadan %69’u çoğunlukla nötropeni olmak üzere 3.dereceden büyük yan etkiler deneyimledi. Hastaların %48’i sitokin salınım sendromu geçirdi. Herhangi bir derecede nörolojik semptom hastaların %10’unda gözlemlendi ve %2’si 3.dereceden büyüktü ve hepsi de iyileşti. Tedavi ilişkili ölüm gözlemlenmedi.(Fowler et al 2020)
Yüksek tam remisyon ve yanıt oranları ile; yüksek risk relapslı ya da yanıtsız iNHL hastalarında CD19-CAR-T hücre tedavisinin etkili olduğu ELARA ve ZUMA-5 çalışmaları ile gösterilmiştir.Genç, çift yanıtsız, ASCT sonrası relaps gibi yüksek risk grubundaki FL hastaları için fayda risk oranı oldukça iyi gözükmesine rağmen daha uzun süreli takibe; özellikle de oldukça etkili rekabet gücü yüksek bispesifik antikor tedavilerin ortaya çıkışı göz önüne alınırsa, tedaviyi daha iyi tanımlamak ve uzun süreli toksisiteleri durdurabilmek için ihtiyaç duyulmaktadır.(Bannerji et al 2020;Hutchings et al 2020a,b;Assouline et al 2020) Veriler marjial zone lenfom iiçin hala yetersizdir. Sonuç olarak faz 3 klinik denemeler CAR-T hücre terapisinin relaps ve yanıtsız NHL’li hastalardaki rolünü göstermek için gereklidir.
Önemli Noktalar:
• Anti CD19 CAR-T hücre tedavisi; relapslı ve yanıtsız folliküler lenfomalı hastalarda yüksek remisyon be yanıt oranlarıyla kabul edilebilir bir güvenililirlik profiline sahiptir.
• Yanıt süresi kabul edilebilir fakat, takip süresi hala kısadır.
• Veriler marjinal bölge lenfomaları için yetersizdir.
• Faz 3 klinik denemeler CAR-T hücre terapisinin relaps ve yanıtsız NHL’li hastalardaki rolünü göstermek için gereklidir.
16. BÖLÜM: Multipl Myelom
Ibrahim Yakoub-Agha ve Hermann Einsele
Bugüne kadar CAR-T hücrelerinin MM’de kullanılmasını araştıran 100’den fazla klinik çalışma clinicaltrials.gov’da kaydedildi. Bazı CD19-yönlendirmeli CAR-T hücre ürünleri onaylansa da (Ghobadi 2018; Yassine et al. 2020), plazma hücrelerinde CD19 yüzey ekspresyonu sınırlıdır ya da yoktur, bu da MM’de yalnız anti-CD19 kullanılan klinik çalışmalarda kesin olmayan yararlılığa yol açar (Garfall et al. 2015,2019). Süper çözünürlüklü mikroskoplar kullanılarak, miyelom hücrelerindeki yüksek orandaki CD-19 tespit edilebilir bu da CD19-tespit edici CAR-T hücrelerinin miyelom hücrelerini doğru tespit ettiğini ve parçaladığını ortaya koyabilir (Nerreter et al 2019). Dikkat, CD19’un başka antijen kombinasyonları kullanılarak, özellikle BMCA, hedeflendiği çalışmalar devam ediyor (Beauvais et al. 2020).
BCMA-yönlendirmeli CAR-T hücreleri çeşitli faz 1 ve 2 klinik çalışmalarında umut vaat eden yararlılık ve güvenlik profili sergilemiştir (Munshi et al. 2021; Brudno et al. 2018; Cohen et al. 2019; Mailankody·et al. 2020; Zhao et al. 2018) Gerçekten de, genel yanıt oranı %75 ile %100 arasında medyan olaydan bağımsız 11 ile 24 ay arasında hayatta kalma süreleri önceden tedavi almış MM hastalarında gözlenmiştir. Bu, bu hasta kohortunda tüm diğer uygun ilaçlardan ve ajanlardan çok daha iyidir.
En az 2 BCMA-yönlendirmeli CAR-T hücre ürünü yakın gelecekte rutin klinik kullanıma girecektir. Klinik çalışmalar dışında, MM hastalarındaki CAR-T hücre terapisinin ana belirteci daha önceden en az 2 kez Pis (proteazom inhibatörleri), iMID’ler (immünomodülatör ajanlar lenalidomid, pormalidomid) ve anti C-3 monoklonal antikorlar içeren terapiyi gören R/R MM hastalarıyla kısıtlıdır.
CAR-T hücre terapisi umut verici görünse de hastalığın kontrolü kısıtlıdır ve neredeyse tüm hastalar tamamen relaps yaşar. Bu CAR-T hücrelerinin, sadece ağır ve dirençli bir hastalığa karşı ağır tedavi almış hastalara verildiği gerçeğini yansıtmaktadır (Beauvais et al. 2020; Gauthier and Yakoub-Agh 2017). Bu nedenle, CAR-T hücre tükenmesi, bitmesi ve hatta hedef antijen BMCA’nın (genellik genetik olarak oldukça kararsızdır) tümör hücrelerindeki ekspresyonunun geri dönüşümsüz olarak kaybı (Da Via et al. 2021; Samu et al. 2021), CAR-T hücre verimliliğini kısıtlayan diğer faktörlerdendir. Bu nedenle yeni hedefler hatta çift hedefleme GPRC5D (de Larrea et al. 2020), SLAMF7 (Gogishvili et al. 2017), CD22 (Radhakrishnan et al. 2020) ve CD38 (Gauthier and Yakoub-Agha 2017; Verklei et al. 2020) gibi) şu anda keşfediliyor.
Ayrıca; verimliliği arttırmak için, CAR-T hücre terapisi, oluşturulan MM spesifik CAR-T hücrelerinin fiziki durumunun ve devamlılığın arttırılması için genel terapinin daha erken seviyelerine taşınmıştır. Bununla birlikte, MM’deki CAR-T hücre terapisi önemli, hayati tehlike seviyesindeki, agresif lenfomalardaki hastalara kıyasla daha az, toksisite ile ilişkilendirilebilir. Bununla birlikte, CAR-T hücrelerini daha iyi bir efektör fonksiyon ve proliferasyon ile yönetmek, CAR-T hücre terapisinin hastalıkta erken seviyelerde kullanıldığı için zor olabilir.
Önemli Noktalar:
• BCMA, MM’deki CAR-T hücre terapisinin ana hedefidir.
•İki tane BCMA yönlendirmeli CAR-T hücre ürünü, yakın zamanda klinik rutine giriyor. (Bir tanesi hali hazırda FDA ve EMA onayı aldı)
• MM hücrelerindeki geri dönüşümsüz BCMA kaybı bazı hastalarda BCMA yönlendirmeli CAR-T hücre terapisinin başarısızlığı ile ilişkilendirildi.
• CAR-T hücre terapisi, MM hastalarında tedavinin ön aşamalarına taşınıyor.
17. BÖLÜM: Diğer Hematolojik Malignitelerdeki Gelişmeler
Paolo Corradini and Lorenz Trümper
Periferal T hücre lenfomaları, bazı heterojen grup nadir hastalıklardan oluşur ve tüm Hodgkin olmayan lenfomaların (Non-Hodgkin Like [NHL]) %10 ile %15’ini oluşturur. Periferal T hücre lenfoma (pTNHL) için uygulanacak ön tedavi; CHOP benzeri (siklofosfamid, adrimisin, vinkristin ve prednizon) etopozidli veya etopozidsiz kemoterapi, devamında uygun hastalara konsodilasyon olarak kök hücre transplantasyonu uygulanır. Bu yaklaşım hastaların %40’ında uzun dönemli ve stabil olarak hastalık belirtilerinin zayıflamasını sağlar; indüksiyon sırasında ilaca karşı erken cevapsızlık hastalarında %25’inde oluşur, kalan hastalar ise tipik olarak 24 ay içinde relaps yapar. Brentuksimab vedotin kullanılabilen Anaplastik büyük hücre lenfomalı hastalar haricinde, relaps ayarında tedavinin bir standardı yoktur. Yüksek doz kemoterapi ve devamında allojenik kök hücre transplantasyonu alamayacak hastalarda prognoz sıkıntılıdır.
CAR-T hücreleri, relapslı/refraktörlü B-hücre lenfomalarında etkileyici sonuçlar göstermiştir ve T-hücre lenfomaları ile ilgili araştırmalar devam etmektedir.
Hedef Antijenler
Doğru antijeni seçme tercihi, T-hücre malignitelerinde CAR-T hücre kullanımını teşkil eder. Birçok hedef antijen hem fizyolojik T-hücreleri hem de yapay CAR-T hücreleri tarafından eksprese edilir. (Tablo 17.1 ve 17.2)
Tablo 17.1 Pan-T hücre antijenleri

Tablo 17.2 Kısıtlanmış ekspresyonlu antijenler

Bu nedenle, paylaşılan antijen ekspresyonu potansiyel olarak bu sorunlara yol açabilir:
CAR-T hücreleri birbirlerini kötü etkileyebilir.
CAR-T hücre infüzyonundan sonra fizyolojik T-hücre donörünün ablasyonuna, bunun da derin ve uzun süreli immün sistem defektlerine ve T-hücre eksikliğine yol açabilir.
T-Hücre Malignitelerde CAR-T Gelişimi
Bazı deneysel olarak üretilmiş; CD5, CD7, CD30 ve TRBC1 (T-hücre beta zincir 1)’i hedefleyen CAR-T hücre ürünleri test edildi. (Tablo 17.3)
Tablo 17.3: T lenfosit antijenlerini hedef alan CAR-T hücreleri
|
CD5'yi hedefleyen CAR-T hücreleri |
Maınoııkiıı et al. (Blood 2015), klinik öncesi deneyim: - CD5 CAR-T hücreleri, malign T-ALL/Ly çizgilerini in vitro olarak ortadan kaldırır ve ksenograft fare modellerinde hastalık ilerlemesini engellemesi - CD28 kostimülatör alanlı ikinci nesil CD5 CAR: T hücrelerinin yüzeyinde CD5 ekspresyonunun kaybıyla birlikte, CD5 CAR-T hücreleri fraktirisite dirençli hale gelir. Hill et al. (Blood 20 İ 9), faz I doz yükseltme çalışması, MAGENTA denemesi: - 9 hasta kaydedildi (4 T-ALL, 5 T-NHL) - CD5 CAR-T hücreleri güvenlidir ve T hücre aplazisini indüklemeden önceden ağır şekilde tedavi edilmiş tekrarlayan/refrakter T-ALL'de klinik yanıtları (tam yanıtta 3 hasta) ve önceden ağır şekilde tedavi edilmiş tekrarlayan/refrakter T-ALL ve T-NHL'de (tam yanıtta 3 hasta) indükleyebilir. |
|
CD7'yi hedefleyen CAR-T hücreleri |
Gomes-Silva et al. (Blood 2017), T hücre malignitelerinin klinik öncesi modelleri: - CAR-T hücrelerinin genişlemesini engelleyen fulminant fratrisit - Hücre yüzeyinden CD7 ekspresyonunun sonlandırılması potansiyel aktivite gösterir Baylor College of Medicine'da A faz 1 çalışması (CRIMSON denemesi) tasarlandı ancak henüz yürürlülüğe konulmadı |
|
TRBC1’i hedefleyen CAR-T hücreleri |
Maciocia et al. (Nat Med 2017), klinik öncesi çalışmalar: - TRBC I'i hedef alan CAR-T hücreleri, TRBCI eksprese eden malign T hücre dizilerini spesifik olarak ortadan kaldırabilir. - TRBCl CAR-T hücreleri, normal TRBC2-pozitif T hücrelerini hedefleyemez University College of Landon tarafından koordine edilen A faz 1/II çalışması (AUTO4), tekrarlayan/refrakter TRBCl-pozitif T hücreli lenfoma hastalarında TRBCI'yi hedefleyen bir CAR-T hücresinin güvenilirliğini ve klinik aktivitesini değerlendiren tek kollu bir çalışmadır.
|
|
CD30’u hedefleyen CAR-T hücreleri
|
Dotti et al. (lmmunol Rev. 2014), klinik öncesi çalışmalar: - CD30'u hedefleyen CAR-T hücreleri, Hodgkin ve anaplastik T hücreli lenfoma hastalarında tümöre özgü T hücreleri üretmesi - CD30 CAR-T hücreleri tarafından tümör tanıma, MHC bağımsızdır - CD30'u hedefleyen CAR-T hücreleri, potansiyel olarak tümör kaçışının üstesinden gelir Bazıları devam eden ve yürürlülüğe giren bazı küçük çalışmalar şunları rapor ediyor: - Bir CAR-T hücresi anti-CD30 ve ant-CD28 kostimülatör alanının antijen bağlama alanına sahip ve diğer CAR-T hücresi kostimülatör alan olarak CD30 ve 4-IBB'yi hedefleyen iki CAR-T yapısı araştırılmaktadır. - Ramos et al. faz I çalışmasında, tekrarlayan/refrakter Hodgkin ve EBV-negatif, CD30-pozitif ALCL'li 9 hasta tedavi edilmiştir; ilgili toksisiteler olmadan 1 hasta tam remisyonda ve 3 hasta stabil hastalıkta olmak üzere sonuçlar umut vericidir. - Wang et al. 18 hasta (17 Hodgkin, bir ALCL); yedi hastadan kısmi bir yanıt elde edildi ve sınırlı akut toksisiteler ancak artan enfeksiyon riski ile altı stabil hastalık elde ettiği kaydedilmiştir.
|