Telomer ve Telomeraz Enziminin Kanserle ve Yaşlanmayla İlişkisi
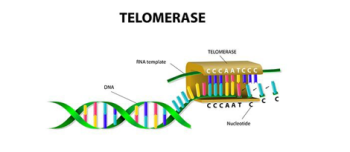
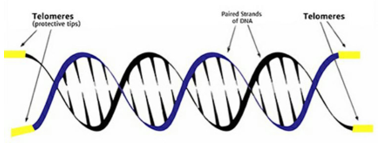
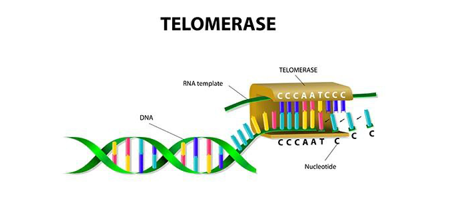
Hücre replikasyonu, telomerlerin korunması ile ve vakaların büyük çoğunluğunda ters transkriptaz telomerazın yeniden aktivasyonu ile ilişkilidir.Telomer/telomeraz makinesini hedeflemek, yeni ve potansiyel olarak geniş spektrumlu bir antikanser terapötik stratejisi sunar, çünkü telomeraz, insan kanserlerinin büyük çoğunluğunda yapısal olarak aşırı eksprese edilir.Telomerler,insan kromozomlarının uçlarında bulunan koruyucu başlıklardır ve Telomerler, kromozom uçlarını programlanmamış DNA onarımı ve bozulmasından korur. Telomerler, bir dizi özel proteine bağlı tekrarlayan DNA'dan (TTAGGG tekrarları) oluşan heterokromatik alanlardır. Telomer tekrarlarının uzunluğu ve telomer bağlayıcı proteinlerin bütünlüğü, telomer koruması için önemlidir. Ayrıca, telomer uzunluğu ve bütünlüğü, bir dizi epigenetik modifikasyon tarafından düzenlenir, böylece telomer fonksiyonunun daha yüksek dereceli kontrolüne işaret eder. Telomer/telomeraz sistemi, hücrenin proliferatif aktivitesine müdahale etmek için iki olasılık sunar: (1) telomeraz aktivitesini inhibe ederek telomer bakımının inhibisyonu; (2) kalıntı telomeraz enzimini aktive etmek veya telomeraz ekspresyonunu indüklemek. Önceki yaklaşım, habis hücrelerin sınırsız çoğalma potansiyelini ortadan kaldırabilirken, telomeraz aktivasyonu, dejeneratif hastalıkların tedavisinde kullanılabilir.DNA kopyalama makinesi, kromozomların en ucundaki DNA'yı tam olarak kopyalayamaz; bu nedenle, replikasyon döngülerinin her biri sırasında yaklaşık 50-200 nükleotid kaybolur ve bu da telomer uzunluğunda kademeli bir azalmaya neden olur.Normal insan hücrelerinde birbirini izleyen her hücre bölünmesiyle telomerler kısalırken, tümörlerde insan telomeraz ters transkriptaz (hTERT) tarafından sürekli olarak uzarlar.Telomeraz kanserlerin %80-95’inde aşırı eksprese edilir ve çok düşük seviyelerde bulunur veya normal hücrelerde neredeyse saptanamaz.Telomerler kısa olduğunda, hücreler replikatif yaşlanma adı verilen geri dönüşü olmayan bir büyüme durdurma durumuna girerler. Çoğu durumda hücreler kanser olmadan önce yaşlanır, bu nedenle kısa telomerlerin neden olduğu büyüme durması güçlü bir kanser karşıtı mekanizma olabilir.
Telomeraz, kanser hücresi büyümesinde çok önemli bir rol oynadığından, antikanser terapötikleri için ideal bir hedef olarak hizmet edebilir. Telomerazın inhibisyonu, telomeraz pozitif tümörlerde hücre yaşlanması ve apoptoz ile sonuçlanan telomer uzunluğunun azalmasına neden olabilir. Küçük molekül inhibitörleri, antisens oligonükleotitler, immünoterapiler ve gen terapileri dahil olmak üzere çeşitli telomeraz inhibisyon stratejileri gözden geçirilmiştir. hTERT veya ribonükleoprotein alt birimi hTER'yi hedefleme. Telomer ve telomeraz düzeneğini hedefleyen G-dörtlü stabilizatörler, tankiraz ve HSP90 inhibitörleri ve T-oligo yaklaşımı da kapsanmaktadır. Bu incelemeye dayanarak, terapötikleri hedefleyen en umut verici mevcut telomerazlar, antisens oligonükleotid inhibitörü GRN163L ve dendritik hücreler (GRVAC1), hTERT peptidi (GV1001) veya kriptik peptidler (Vx-001) kullanan immünoterapilerdir. Bu ajanların çoğu, çeşitli tümörleri olan hastalarda faz I ve II klinik deneylerine girmiş ve tümör hücresi büyümesinde azalma, genel hastalık sağkalımında artış, ileri evre tümörlerde hastalık stabilizasyonu ve tam/kısmi yanıtlarla kanıtlandığı üzere iyi yanıt oranları göstermiştir.Çoğu terapötik, standart terapilerle birlikte kullanıldığında daha etkili olduğunu göstermiştir.
Bu konu üzerine yapılan bir çalışma olarak arttırılmış kanser direncine sahip farelerde telomeraz ekspresyonunu zorlayarak telomerazın yaşlanma karşıtı aktivitesinin gösterildiği çalışmalar sonucunda telomerler normal uzunlukta olsa bile telomer disfonksiyonunun, erken doku dejenerasyonu, kromozomal anormalliklerin kazanılması ve neoplastik lezyonların başlaması gibi problemler ortaya çıkarmıştır. Telomerazın neden olduğu telomer uzunluğu manipülasyonlarının doku mühendisliğinde ve kanser dahil genetik hastalıkların altında yatan moleküler mekanizmaların incelenmesinde faydalı olabileceğini gösterir.
Hazırlayan/Derleyen:Osman Tümer KARADOĞAN
KAYNAKÇA
https://pubmed.ncbi.nlm.nih.gov/17945408/
https://pubmed.ncbi.nlm.nih.gov/22841437/
https://pubmed.ncbi.nlm.nih.gov/21115533/
https://pubmed.ncbi.nlm.nih.gov/11280022/
https://pubmed.ncbi.nlm.nih.gov/15862745/